网址:http://m.1010jiajiao.com/timu3_id_372994[举报]
某化学探究学习小组拟利用下列装置测定某黑色铁的氧化物矿样的化学式(设矿样不含其它杂质)。主要化学反应为:
①H2C2O4(乙二酸)CO2↑+CO↑+H2O ②Fe![]() O
O![]() +
+![]() CO=
CO=![]() Fe+
Fe+![]() CO2
CO2
他们要测定的数据是矿样质量和反应②所生成的CO2的质量[用m(Fe![]() O
O![]() )和m(CO2)表示]。所需仪器(连同药品)的示意图如下(必要时有的仪器可重复使用)
)和m(CO2)表示]。所需仪器(连同药品)的示意图如下(必要时有的仪器可重复使用)
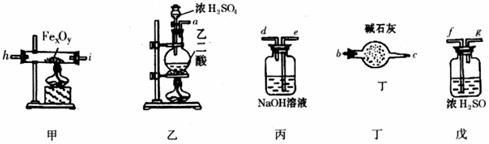
(1)假设洗气(或吸气)装置丙、丁、戊内的反应进行得都完全,按气体从左至右的流向将上述仪器组装起来(用接口字母a、b……表示):
接 , 接 , 接 , 接 , c 接 f
(2)实验中有一件仪器前后用到两次,前边用它的目的是 ,后边又用它的目的是 。
(3)为了保护环境,怎样处理仪器末端导出的CO(写出具体方法)
(4)该小组测得m(Fe![]() O
O![]() )=15.2g,m(CO2)=11.0g,则x:y为
)=15.2g,m(CO2)=11.0g,则x:y为
A.4:5 B.1:1 C.2:3 D.3:4
在该实验中,反应前Fe![]() O
O![]() 为黑色,反应后生成的Fe也为黑色,难以确定Fe
为黑色,反应后生成的Fe也为黑色,难以确定Fe![]() O
O![]() 是否完全被还原,若仍有Fe
是否完全被还原,若仍有Fe![]() O
O![]() 剩余,则所测的x:y值比实际值 (填偏低,偏高或不影响)采取什么措施可以避免上述原因引起的偶然误差:
剩余,则所测的x:y值比实际值 (填偏低,偏高或不影响)采取什么措施可以避免上述原因引起的偶然误差:
(5)仍用上述提供的仪器和药品(必要时可以少选用也可以按新的顺序进行组装),同样测定两种物质的质量,便可计算出x和y的比值,写出要测定的两种数据可能的组合:
① ② ③
(若不够三种组合,可不必填满;若多于三种组合,可自行增加)
查看习题详情和答案>>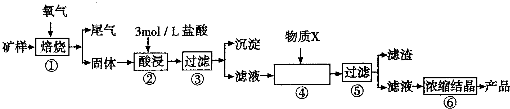
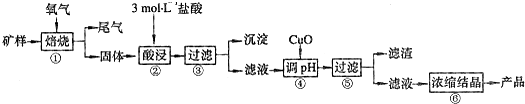
已知:在20℃时,氯化铜的溶解度是73g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表.
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(1)步骤①的焙烧过程中需要通入氧气.在实验室中使用中学化学常见物质用图1所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式
| ||
| ||
(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物.若在实验室中以碱液吸收处理之,下列A、B、C装置中可行的是

(3)步骤②酸浸过程中,需要用到3mol/L的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有
(4)步骤④加入物质X的目的是
A.氧化铜 B.稀盐酸 C.氨水 D.氧化亚铁
(5)在整个生产流程中,共需要进行
回答下列问题:
(1)步骤①的焙烧过程中需要通入氧气.在实验室中使用中学化学常见物质用图1所示装置制取氧气,请简述该装置的气密性检验方法
| ||
| ||
(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物,若在实验室中以碱液吸收处理之,图2 A、B、C装置中可行的
(3)步骤②酸浸过程中,需要用到3mol?L-1盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有
(4)上述流程中,从矿样到产品
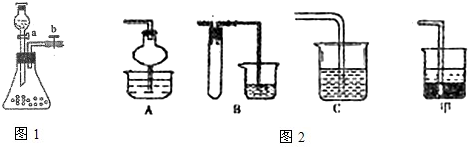
(15分)某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O 晶体。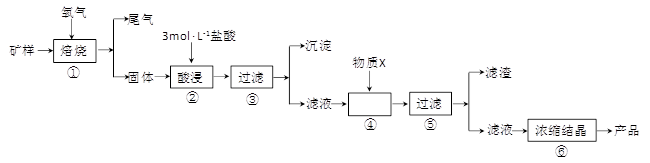
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
| 金属离子 | 氢氧化物开始沉淀的pH | 氢氧化物沉淀完全的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |

(l)步骤①的焙烧过程中需要通入氧气。在实验室中,可使用常见化学物质利用上图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:______________________、______________________。
(2)焙烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:____________________、__________________。
(3)步骤②酸浸过程中,需要用到3 mol · L-1的盐酸100 mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_______________________________________。
(4)步骤④加入物质X的目的是_________________________________________,物质X 可以选用下列物质中的______________________。
(A)氢氧化钠 (B)稀盐酸 (C)氨水 (D)氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol · L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]=_____。 查看习题详情和答案>>
(15分)某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,取该矿样为原料生产CuC12·2H2O 晶体。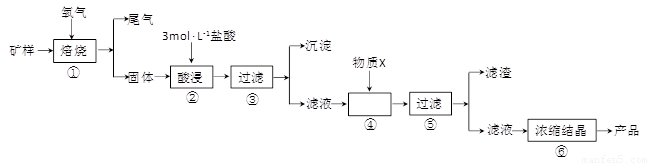
已知:常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
|
金属离子 |
氢氧化物开始沉淀的pH |
氢氧化物沉淀完全的pH |
|
Fe2+ |
7.0 |
9.0 |
|
Fe3+ |
1.9 |
3.2 |
|
Cu2+ |
4.7 |
6.7 |
回答下列问题:
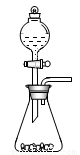
(l)步骤①的焙烧过程中需要通入氧气。在实验室中,可使用常见化学物质利用上图所示装置制取氧气,试写出熟悉的符合上述条件的两个化学方程式:______________________、______________________。
(2)焙烧产生的尾气中含有的一种气体是形成酸雨的污染物,若将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:____________________、__________________。
(3)步骤②酸浸过程中,需要用到3 mol · L-1的盐酸100 mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有_______________________________________。
(4)步骤④加入物质X的目的是_________________________________________,物质X 可以选用下列物质中的______________________。
(A)氢氧化钠 (B)稀盐酸 (C)氨水 (D)氧化铜
(5)当溶液中金属离子浓度低于1×10-5 mol · L-1时,认为该金属离子沉淀完全,则Ksp[Fe(OH)2]=_____。
查看习题详情和答案>>