摘要:11.在将显微镜的低倍镜转换成高倍镜并寻找物象的过程中.不应出现的操作过程是( ) A.转动细调节器 B.转动粗调节器 C.转动转换器 D.调节反光镜和光圈
网址:http://m.1010jiajiao.com/timu3_id_37298[举报]
亚硝酸钠俗称“工业盐”,其外观与食盐相似,有咸味.亚硝酸钠进入人体后,可将血液中的低铁血红蛋白氧化成高铁血红蛋白,失去输送氧气的功能,致使组织缺氧,出现青紫而中毒.美蓝是亚硝酸盐中毒的有效解毒剂.下列有关说法中不正确的是( )
查看习题详情和答案>>
亚硝酸钠俗称“工业盐”,其外观与食盐相似,有咸味.亚硝酸钠进入人体后,可将血液中的低铁血红蛋白氧化成高铁血红蛋白,失去输送氧气的功能,致使组织缺氧,出现青紫而中毒.美蓝是亚硝酸盐中毒的有效解毒剂.下列有关说法中不正确的是( )
| A、在中毒过程中血红蛋白被还原 | B、药品美蓝在解毒过程中作还原剂 | C、中毒时亚硝酸钠发生还原反应 | D、可用稀硝酸、AgNO3溶液区分亚硝酸钠与食盐 |
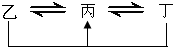 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:(1)写出化合物甲的电子式:


(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式
3NH3?H2O+Al3+=Al(OH)3↓+3NH4+
3NH3?H2O+Al3+=Al(OH)3↓+3NH4+
;写出均含有F元素的乙与丁在溶液中发生反应的离子方程式Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
.(3)由A、C元素组成的化合物戊和A、E元素组成的化合物己,式量均为34.其中戊的熔沸点高于己,其原因是:
H2O2分子间存在氢键
H2O2分子间存在氢键
.(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐.请写出由A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式
NH4)2Fe(SO4)2或(NH4)2Fe(SO4)2?6H2O或(NH4)2SO4?FeSO4?6H2O
NH4)2Fe(SO4)2或(NH4)2Fe(SO4)2?6H2O或(NH4)2SO4?FeSO4?6H2O
.该复盐是一种重要的化学试剂,据中学课本介绍,工业上常用如下方法制取:将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体.写出相关反应的化学方程式(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2?6H2O
(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2?6H2O
,析出该复盐晶体的原理是硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多
硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多
.(15分)元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大。其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g·L—1,C元素原子的最外层电子数是其内层电子数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):

其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、
丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应。请回答下列问题:
(1)写出化合物甲的电子式: 。
(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式 ;
写出均含有F元素的乙与丁在溶液中发生反应的离子方程式 。
(3)由A、C元素组成化合物的戊和A、E元素组成的化合物己,式量均为34。其中戊的熔沸点高于己,其原因是: 。
(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐。请写出由A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式 。该复盐是一种重要的化学试剂,据中学课本介绍,工业上常用如下方法制取:将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体。写出相关反应的化学方程式 ,析出该复盐晶体的原理是 。
查看习题详情和答案>>