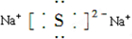摘要:18.如右图所示.位于竖直平面内的固定光滑圆环轨道与水平面相切于M点.与竖直墙壁相切于A点.竖直墙壁上另一点B与M的连线和水平面的夹角为60°.C是圆环轨道的圆心.D是圆环上与M靠得很近一点.已知在同一时刻.a.b两球分别由A.B两点从静止开始沿光滑倾斜直轨道运动到M点,c球由C点自由下落到M点,d球从D点由静止出发沿圆环运动到M点.则 A.a球最先到达M点 B.b球最先到达M点 C.c球最先到达M点 D.d球最先到达M点 选择题二(本题包括3个小题.每小题6分.共18分.每小题给出的四个选项中.至少有两个选项是正确的.全部选对的得6分.选对但不全的得3分.有选错的得0分)
网址:http://m.1010jiajiao.com/timu3_id_372905[举报]
 有A、B、C、D、E、M、X七种元素.其相关信息如下:
有A、B、C、D、E、M、X七种元素.其相关信息如下:| 相关信息 | |
| ① | A的基态原子2p轨道中有三个未成对电子 |
| ② | A、B元素的常见单质是构成空气的主要成分 |
| ③ | C是电负性最大的元素 |
| ④ | D是主族元素,基态原子有四个能层,且最外能层上只有两个电子 |
| ⑤ | D、E、M、X四种元素处于同一周期; M与E又位于同一族,M的原子序数比E多1,M的基态原子中含有三个未成对电子; X原子外围电子排布式为3d104s1 |
(1)A元素的电负性与B的电负性相比,电负性较大的是
O
O
(填写元素符号).M的原子序数为27
27
;X元素在周期表中的位置是第四周期第IB族
第四周期第IB族
.(2)A与C组成AC3分子的VSEPR模型为
四面体
四面体
,AB3-离子的空间构型为平面三角形
平面三角形
.(3)画出B元素原子的核外电子排布图
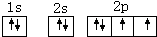

1s22s22p63s23p63d5
1s22s22p63s23p63d5
.;(4)E、X晶体晶体的堆积模型依次为体心立方堆积、面心立方最紧密堆积,其配位数依次为
8、12
8、12
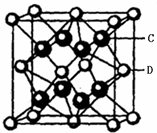
.(5)C与D可形成离子化合物,其晶胞结构如右图所示.若该晶胞的边长为500.0pm.若该晶体的密度为
4.15
4.15
g/cm3(列式并计算). 已知短周期元素X、Y、Z的原子序数依次增大,且Z的原子序数等于X和Y的原子序数之和,Y的原子半径是同同期元素中最小的,Z元素在地壳中的含量居第二位.根据以上叙述下列说法中正确的是( )
已知短周期元素X、Y、Z的原子序数依次增大,且Z的原子序数等于X和Y的原子序数之和,Y的原子半径是同同期元素中最小的,Z元素在地壳中的含量居第二位.根据以上叙述下列说法中正确的是( )
查看习题详情和答案>>
(2012?焦作一模)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上.部分含钒物质在水中的溶解性如下表所示:
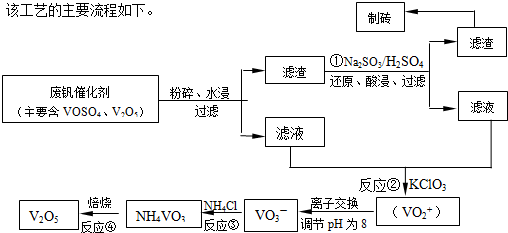
请回答下列问题:
(1)23V在元素周期表位于第
(2)反应①的目的是
(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式
(4)用酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,写出配平后完整的离子方程式.
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变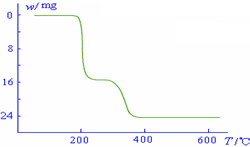 化的曲线如右图所示.则NH4VO3在分解过程中
化的曲线如右图所示.则NH4VO3在分解过程中
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O.
查看习题详情和答案>>
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请回答下列问题:
(1)23V在元素周期表位于第
四
四
周期VB
VB
族.工业上由V2O5冶炼金属钒常用铝热剂法,其用化学方程式表示为3V2O5+10Al
6V+5Al2O3
| ||
3V2O5+10Al
6V+5Al2O3
.
| ||
(2)反应①的目的是
将V2O5转化为可溶性的VOSO4
将V2O5转化为可溶性的VOSO4
.(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式
NH4++VO3-=NH4VO3↓
NH4++VO3-=NH4VO3↓
.(4)用酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,写出配平后完整的离子方程式.
2
2
VO2++1
1
H2C2O4+2
2
H+→2
2
VO2++2
2
CO2+2H2O
2H2O
.(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变
 化的曲线如右图所示.则NH4VO3在分解过程中
化的曲线如右图所示.则NH4VO3在分解过程中B
B
.A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O.
 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:(1)写出C、D、E三种原子第一电离能由大到小的顺序为
F>N>O
F>N>O
.(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为
H2O>NH3>CH4
H2O>NH3>CH4
,根据价层电子对互斥理论预测BA2D的分子构型为平面三角形
平面三角形
.(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个BC-.与A同族且相差两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示)
NaFe2(CN)6
NaFe2(CN)6
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如右图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
TiN>MgO>KCl
TiN>MgO>KCl
.MgO晶体中一个Mg2+周围和它最邻近且等距离的O2-有6
6
个.(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是
Cr2O3
Cr2O3
. X、Y、Z是ⅠA~ⅦA族的三种非金属元素,它们在周期表中的位置如右图所示.试回答:
X、Y、Z是ⅠA~ⅦA族的三种非金属元素,它们在周期表中的位置如右图所示.试回答: