摘要:24.将9.6g铜加入到50mL 12mol·L-1 HNO3溶液中.待铜全部溶解后.剩余溶液的pH=0.产生的气体(含NO.NO2.N2O4)折算成标准状况下的体积为4.48L.请计算: (1)被还原的硝酸的物质的量. (2)所得气体中NO.NO2的物质的量.
网址:http://m.1010jiajiao.com/timu3_id_372634[举报]
将9.6g铜加入50mL12mol?L-1的HNO3溶液中,待铜全部溶解后,剩余溶液中H+的浓度为1mol/L(忽略溶液体积的变化),产生的气体是NO、NO2、N2O4的混合气体,折算成标准状况下的体积为4.48L。请计算所得气体中各成分的物质的量。
查看习题详情和答案>>
金属铜能被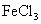 的浓溶液腐蚀.其化为反应是:
的浓溶液腐蚀.其化为反应是:
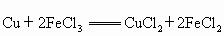 .
.
现将有铜的印刷线路板浸入120mL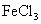 的溶液中,有9.6g铜被腐蚀掉,取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物,则:①溶液中主要存在哪些离子?②离子的物质的量浓度各是多少(设溶液体积不变)?
的溶液中,有9.6g铜被腐蚀掉,取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物,则:①溶液中主要存在哪些离子?②离子的物质的量浓度各是多少(设溶液体积不变)?
在500gCuSO4溶液中插入两根电极,一极为铁,另一极为含杂质锌均匀的粗铜。通电一段时间后,切断电源,立即将电极取出,此时铁电极上析出9.6g铜,而电解质溶液变为500.02g。若铜电极上铜、锌的组成比例与通电前相同,求铜电极中含杂质锌的质量分数。
查看习题详情和答案>>