摘要:3.NaBH4含有BH4-离子而具有极强的还原性.在金属和非金属底物材料上用NaBH4镀镍.可得到耐腐蚀.坚硬的保护层(3Ni3B+Ni).反应方程式为: 20NiCl2+16NaBH4+34NaOH+6H2O=2(3Ni3B+Ni)+10NaB(OH)4+40NaCl+35H2↑ 关于该反应的说法不正确的是: ① B元素在反应前后化合价不变,② (3Ni3B+Ni)是还原产物.H2是氧化产物,③ 每生成1molH2时.转移的电子数为2mol,④ NaBH4的还原性强于H2,⑤ H2中的H元素来自于NaBH4和H2O,⑥ (3Ni3B+Ni)是一种化合物.化学式为Ni10B. A.①②③⑥ B.①④⑤⑥ C.②③④⑥ D.②③⑤⑥
网址:http://m.1010jiajiao.com/timu3_id_372255[举报]
NaBH4(硼氢化钠)是典型的离子化合物,在有机反应中可将醛、酮变为醇.
(1)硼氢化钠与水反应的离子方程式是BH4-+2H2O=BO2-+4H2↑,该反应中氧化剂是
(2)已知HBO2是弱酸,溶液的酸性对硼氢化钠与水的反应速率有影响,酸性越强,其反应速率越
(3)硼氢化钠能把许多金属离子还原为金属单质,为抑制它与水的反应,反应在
查看习题详情和答案>>
(1)硼氢化钠与水反应的离子方程式是BH4-+2H2O=BO2-+4H2↑,该反应中氧化剂是
H2O
H2O
,生成1mol H2时转移电子的数目是6.02×1023
6.02×1023
.(2)已知HBO2是弱酸,溶液的酸性对硼氢化钠与水的反应速率有影响,酸性越强,其反应速率越
快
快
,这是因为H+与BO2-结合生成弱电解质HBO2,减小了BO2-浓度,使反应速率加快.或BO2-水解使溶液呈碱性,加酸能促进BO2-的水解,减小BO2-浓度,故反应速率加快
H+与BO2-结合生成弱电解质HBO2,减小了BO2-浓度,使反应速率加快.或BO2-水解使溶液呈碱性,加酸能促进BO2-的水解,减小BO2-浓度,故反应速率加快
.(3)硼氢化钠能把许多金属离子还原为金属单质,为抑制它与水的反应,反应在
碱性
碱性
(填“酸性”“中性”或“碱性”)条件下进行,试完成并配平金离子(Au3+)被硼氢化钠还原的离子方程式:8
8
Au3++3
3
BH4-+24OH-
24OH-
=8
8
Au↓+3
3
BO2-+18H2O
18H2O
. 据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
查看习题详情和答案>>
 (2013?盐城一模)[物质结构与性质]
(2013?盐城一模)[物质结构与性质]氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料.
①Ti2+基态的电子排布式可表示为
1s22s22p63s23p63d2
1s22s22p63s23p63d2
.②B
| H | - 4 |
正四面体
正四面体
(用文字描述).(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2
| 储氢 |
| 输氢 |
abc
abc
(多项选择).a.NH3分子中N原子采用sp3杂化
b.相同压强时,NH3沸点比PH3高
c.[Cu(NH3)4]2+离子中,N原子是配位原子
d.CN-的电子式为
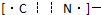
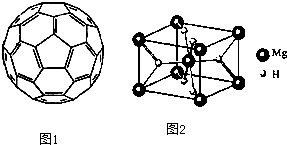
(3)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子.
①C60晶体易溶于苯、CS2,C60是
非极性
非极性
分子(填“极性”或“非极性”).②1mol C60分子中,含有σ 键数目为
90NA
90NA
.(4)MgH2是金属氢化物储氢材料,其晶胞结构如图2所示,已知该晶体的密度为a g?cm-3,则晶胞的体积为
| 52 |
| a.NA |
| 52 |
| a.NA |
 (2011?江苏二模)据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )
(2011?江苏二模)据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )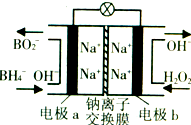 (2013?漳州二模)某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
(2013?漳州二模)某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )