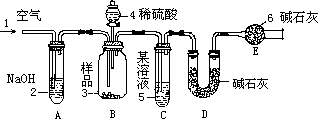
摘要:工业纯碱中含有少量NaCl杂质.实验室利用下图装置通过纯碱与酸反应产生CO2的量测定工业纯碱中Na2CO3的质量分数. 可供选择的试剂: 稀H2SO4.稀盐酸.NaOH溶液.浓硫酸.碱石灰.纯碱试样 (1)从B中反应开始到反应结束.要缓缓鼓入空气.其作用是 . A中盛放的试剂是 . (2)装置B中分液漏斗盛放的酸是 .B中反应的离子方程式是 . (3)装置C中盛放的试剂是 .装置E的作用是 . (4)实验操作时.必须测定记录的数据是(用文字说明.需注明“反应前 或“反应后 .可不填满.也可补充) ① ② ③ ④
网址:http://m.1010jiajiao.com/timu3_id_372001[举报]
| |||||||||||||||||||
| |||||||||||||||||||
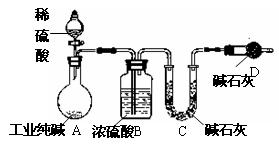
工业纯碱中常常含有NaCl、Na2SO4等杂质.为粗略测定某工业纯碱的纯度,设计了如图所示的实验装置.依据实验设计,请回答:

(1)装置B中盛装稀硫酸的仪器名称是 ;B中发生反应的离子方程式为 .
(2)为达到实验目的,一次实验中至少应进行称量操作的次数为 .
(3)如果不用装置E,会导致实验结果 (填“偏高”、“偏低”或“无影响”).
(4)最后一次称量前,打开活塞K缓缓通入气体的目的是 .
查看习题详情和答案>>

(1)装置B中盛装稀硫酸的仪器名称是
(2)为达到实验目的,一次实验中至少应进行称量操作的次数为
(3)如果不用装置E,会导致实验结果
(4)最后一次称量前,打开活塞K缓缓通入气体的目的是