网址:http://m.1010jiajiao.com/timu3_id_371972[举报]
氧化铜有多种用途,如用作玻璃着色剂,油类脱硫剂等,为获得纯净的氧化铜并探究其性质,某同学查找了溶度积数据并通过计算得到有关信息(见下表),用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
|
物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
㈠制备氧化铜
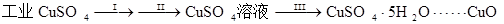
⑴步骤Ⅰ的操作是加入水和少量硫酸溶解样品并过滤,目的是除去不溶性杂质,这一步骤中加酸的作用是 。
⑵步骤Ⅱ的操作是:滴加H2O2溶液,稍加热;待反应完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。
①这一步骤的目的是 ,
②写出加入H2O2溶液时发生反应的离子方程式
③控制溶液pH=3.5的目的是 ,
⑶步骤Ⅲ的目的是得到CuSO4·5H2O晶体,操作是 ,水浴加热烘干所得固体。水浴加热的特点是 。
㈡探究氧化铜性质
⑴取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是 。
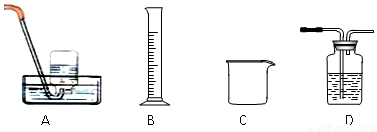
⑵为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器或装置为 。(填写序号)
查看习题详情和答案>>
铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为
A.Fe(OH)3;Fe2O3 B.Fe(OH)2;FeO
C.Fe(OH)2;Fe(OH)3;Fe3O4 D.Fe2O3;Fe(OH)3
查看习题详情和答案>>14分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下: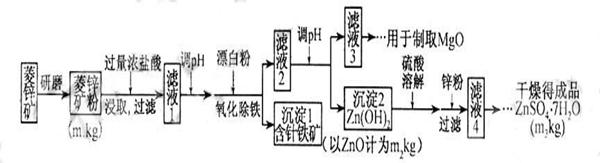
(1) 将菱锌矿研磨成粉的目的是 。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学相对分子质量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
| | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6×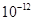 | — | 6.8×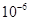 | 2.8×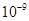 |
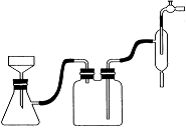
(6)抽滤装置如下图所示,该装置中的错误之处是___________;抽滤完毕或中途需停止抽滤时,应先_________________________,然后_______________________。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。 查看习题详情和答案>>
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下: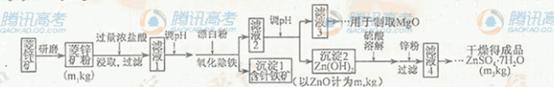
(1) 将菱锌矿研磨成粉的目的是_____。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的ph时,理论上可选用的最大区间为______。
| | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6×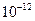 | — | 6.8×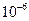 | 2.8×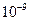 |
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。 查看习题详情和答案>>
(10分)工业上制取CuCl2的生产流程如下:
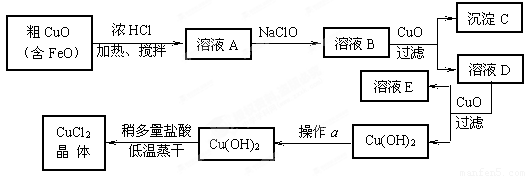
请结合下表数据,回答下列问题:
|
物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
⑴ 溶液A中加入NaClO的目的是 ;
此反应离子方程式为 ;
⑵ 在溶液B中加入CuO的作用是 ;
⑶ 操作a的目的是 ;
⑷ 在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用多量盐酸和低温蒸干的目的是 。
查看习题详情和答案>>