网址:http://m.1010jiajiao.com/timu3_id_371532[举报]

(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是______;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为:______;
(3)过程③中,需加入的物质是______;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架,还需要的仪器有______;
(5)过程⑤调节pH可选用下列试剂中的______(填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70-80℃,目的是______;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验.
①用分析天平称取2.700g样品;
②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;
③过滤、洗涤、干燥,称量,得固体质量为3.495g.若该聚铁主要成分为[(Fe(OH)(SO4)]n;
则该聚铁样品中铁元素的质量分数为______.(假设杂质中不含铁元素和硫元素)
查看习题详情和答案>>
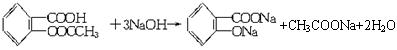 (相对分子质量为180)。已知:阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应)。某课外学习小组为检验阿司匹林有效成分的官能团并测定其在药片中的含量,进行了如下实验:
(相对分子质量为180)。已知:阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应)。某课外学习小组为检验阿司匹林有效成分的官能团并测定其在药片中的含量,进行了如下实验: Ⅰ.验证乙酰水杨酸中具有羧基和酯的结构(—COOR)。
①将一片阿司匹林研碎后溶于水,静置,各取清液2 mL于两支洁净的试管中;
②向一支试管中加入____________,若观察到____________,即证明乙酰水杨酸中有羧基;
③向另一支试管中加入适量NaOH溶液,加热几分钟,冷却后逐滴滴入稀H2SO4,再向其中滴入FeCl3溶液,边加边振荡,若观察到溶液逐渐变为____________色,即证明乙酰水杨酸中具有酯的结构。
回答下列问题:
(1)将上述三处空白补充完整。
(2)实验中滴加稀H2SO4的作用是_____________________________________________。
Ⅱ.该学习小组设计了如下实验方案测定乙酰水杨酸在药片中的含量。
①称取阿司匹林样品m g;②将样品研碎,溶于V1 mL a mol·L-1 NaOH溶液中(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;③向锥形瓶中滴加几滴指示剂,用浓度为b mol·L-1的盐酸来滴定未反应的NaOH,消耗盐酸的体积为V2 mL。
回答下列问题:
(1)阿司匹林中加入过量NaOH溶液并加热发生反应的化学方程式为____________;其中加热目的是____________________________________________________________。
(2)步骤③中若用酚酞作指示剂,如何判断滴定终点?________________________________
____________________________________________________________________。
(3)根据实验中记录的数据,阿司匹林药片中乙酰水杨酸质量分数的表达式为___________
_____________________________________________________________________。
查看习题详情和答案>> 工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:方案一:取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量.
方案二:用0.100mol/L盐酸滴定.
方案三用稀酸将CO32-转化为CO2,测定CO2的质量.
(1)方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作.称量时所需定量实验仪器为
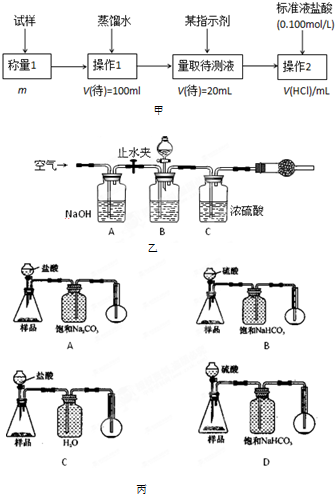
(2)方案二的具体过程如图甲:
①操作1所需要的仪器有
②滴定时选择的指示剂为甲基橙.当溶液
③为减少偶然误差,通常的处理办法是
④滴定时若锥形瓶内有少量液体溅出,则测定结果
(3)方案三的实验装置如图乙:操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g.该方案样品中纯碱的质量分数为
| 53(W3-W1) |
| 22W2 |
| 53(W3-W1) |
| 22W2 |
(4)若用如图丙装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量.则下列装置中,最合理的是
 工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
工业生产的纯碱中常含有少量NaCl杂质.为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
方案一:取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量.
方案二:用0.100mol/L盐酸滴定.
方案三用稀酸将CO32-转化为CO2,测定CO2的质量.
(1)方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作.称量时所需定量实验仪器为______.判断是否达到恒重的标准是______.
(2)方案二的具体过程如图甲:
①操作1所需要的仪器有______.
②滴定时选择的指示剂为甲基橙.当溶液______时,说明达到了滴定终点.
③为减少偶然误差,通常的处理办法是______.
④滴定时若锥形瓶内有少量液体溅出,则测定结果______.(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果______.
(3)方案三的实验装置如图乙:操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g.该方案样品中纯碱的质量分数为______(用代数式表示).上图中装置A的作用是______.装置C的作用是______.有同学认为空气中的水蒸气会进入干燥管导致测量结果______(填“偏大”、“偏小”或“无影响”).改进措施可以是______.
(4)若用如图丙装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量.则下列装置中,最合理的是______.(选填序号)
查看习题详情和答案>>
方案一:取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量.
方案二:用0.100mol/L盐酸滴定.
方案三用稀酸将CO32-转化为CO2,测定CO2的质量.
(1)方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作.称量时所需定量实验仪器为______.判断是否达到恒重的标准是______.
(2)方案二的具体过程如图甲:
①操作1所需要的仪器有______.
②滴定时选择的指示剂为甲基橙.当溶液______时,说明达到了滴定终点.
③为减少偶然误差,通常的处理办法是______.
④滴定时若锥形瓶内有少量液体溅出,则测定结果______.(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果______.
(3)方案三的实验装置如图乙:操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g.该方案样品中纯碱的质量分数为______(用代数式表示).上图中装置A的作用是______.装置C的作用是______.有同学认为空气中的水蒸气会进入干燥管导致测量结果______(填“偏大”、“偏小”或“无影响”).改进措施可以是______.
(4)若用如图丙装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量.则下列装置中,最合理的是______.(选填序号)