网址:http://m.1010jiajiao.com/timu3_id_371528[举报]
工业生产粗硅的主要原理为:SiO2+2C 3273K Si(粗)+2CO↑。
(1)若在制粗硅的过程中同时生成了碳化硅,且生成的硅和碳化硅的物质的量之比为5∶1,则参加反应的C和SiO2的质量比为 ?? 。
(2)工业上可通过如下流程由粗硅制取纯硅:
| ||||||
|
| |||||
![]()
![]()
![]() Si(粗) SiCl4(l) Si(纯)
Si(粗) SiCl4(l) Si(纯)
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产100.8t纯硅需纯度为75%的石英砂多少吨?
(3)工业上还可以通过下图所示的流程来制取纯硅:
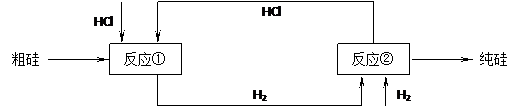
反应①: Si(粗)+3HCl(g) 553~573K SiHCl3(l)+H2(g)
反应②: SiHCl3+H2 1373K Si(纯)+3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率为75%,反应②中H2的利用率为80%,则在下轮次的生产中,需补充投入HCl和H2的体积比为多少?
查看习题详情和答案>>(1)若在制粗硅的过程中同时生成了碳化硅,且生成的硅和碳化硅的物质的量之比为5∶1,则参加反应的C和SiO2的质量比为 ? 。
(2)工业上可通过如下流程由粗硅制取纯硅:
| ||||||
|
| |||||


 Si(粗) SiCl4(l) Si(纯)
Si(粗) SiCl4(l) Si(纯)若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产100.8t纯硅需纯度为75%的石英砂多少吨?
(3)工业上还可以通过下图所示的流程来制取纯硅:
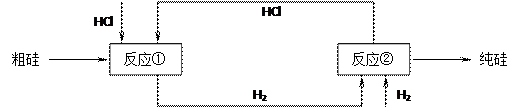
反应①: Si(粗)+3HCl(g) 553~573K SiHCl3(l)+H2(g)
反应②: SiHCl3+H2 1373K Si(纯)+3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率为75%,反应②中H2的利用率为80%,则在下轮次的生产中,需补充投入HCl和H2的体积比为多少?
单晶硅是现代信息基础材料。工业上,硅是在电炉中用炭粉还原二氧化硅制得的。
(1)若往电炉里加入二氧化硅和炭粉的混合物,通电,使它们发生如下反应生成硅:2C+SiO2 2CO↑+Si
2CO↑+Si
从保护生态环境和建设节约型社会等方面来说,在该生产环节中需要注意的主要问题是________________________________________________________________________
________________________________________________________________________。
(2)以上生产所得到的硅不纯,称为“粗硅”。一些高新技术产品的元件中使用的硅是极其纯净、几乎没有任何缺陷的单晶硅。
①工业上,硅的提纯原理为在加热下让粗硅与氯气反应,其产物在高温下被氢气还原,从而得到较纯的硅。请写出上述过程中有关反应的化学方程式
________________________________________________________________________
________________________________________________________________________。
②实验室中,将细沙粉(SiO2)与镁粉混合加热,也可制得粗硅。这种粗硅往往含有过量的镁、氧化镁和硅化镁(Mg2Si),这些杂质可用盐酸除去(提示:Mg2Si与盐酸反应的产物之一是SiH4)。请写出在实验过程中所发生的氧化还原反应的化学方程式
________________________________________________________________________
________________________________________________________________________。
查看习题详情和答案>>