网址:http://m.1010jiajiao.com/timu3_id_370778[举报]
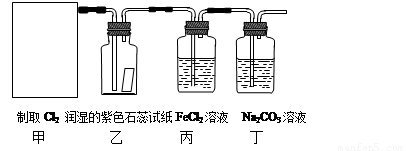
(10分)实验室常用二氧化锰和浓盐酸反应制取氯气:MnO2+4HCl(浓)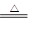 MnCl2 + Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
MnCl2 + Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。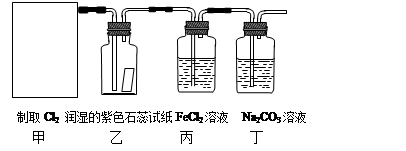
⑴在该实验中,甲部分的装置是 (填写字母)。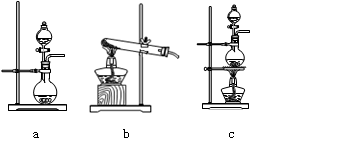
⑵乙装置中可观察到的颜色变化为: 。
⑶丙装置中FeCl2溶液与Cl2反应的离子方程式是 。
⑷丁装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是 。
⑸该实验存在明显的缺陷,改进的方法是 。
(10分)实验室常用二氧化锰和浓盐酸反应制取氯气:MnO2+4HCl(浓)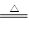 MnCl2
+ Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
MnCl2
+ Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
⑴在该实验中,甲部分的装置是 (填写字母)。
⑵乙装置中可观察到的颜色变化为: 。
⑶丙装置中FeCl2溶液与Cl2反应的离子方程式是 。
⑷丁装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是 。
⑸该实验存在明显的缺陷,改进的方法是 。
查看习题详情和答案>>
(10分)实验室常用的几种气体发生装置如图A、B、C所示:
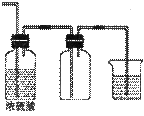
A B C D
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是 。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是 (填序号,下同。)①密度 ②颜色 ③溶解性 ④热稳定性
下图是某学生设计收集气体的几种装置,其中不可行的是 。

(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的_______,
①CO2 ② NO ③ Cl2 ④H2
其中在D装置中连接小烧杯的目的是________________________。
查看习题详情和答案>>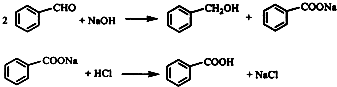
已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃).
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸.
③石蜡油沸点高于250℃
实验步骤如下:
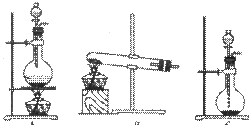
①向图l 所示装置中加入8g氢氧化钠和30mL水,搅拌溶解.稍冷,加入10mL苯甲醛.开启搅拌器,调整转速,使搅拌平稳进行.加热回流约40min.
②停止加热,从球形冷凝管上口缓缓加入冷水20mL,摇动均匀,冷却至室温.反应物冷却至室温后,用乙醚萃取三次,每次
10mL.水层保留待用.合并三次萃取液,依次用5mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10mL水洗涤,分液水层弃去所得醚层进行实验③.
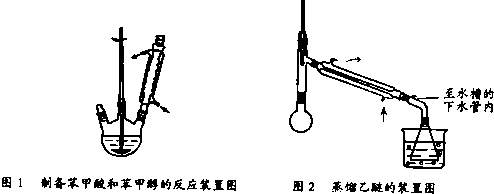
③将分出的醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞.将锥形瓶中溶液转入图2 所示蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必需改变加热方式,升温至140℃时应对水冷凝管冷凝方法调整,继续升高温度并收集203℃~205℃的馏分得产品A.
④实验步骤②中保留待用水层慢慢地加入到盛有30mL浓盐酸和30mL水的混合物中,同时用玻璃棒搅拌,析出白色固体.冷却,抽滤,得到粗产品,然后提纯得产品B.
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需
(2)饱和亚硫酸氢钠溶液洗涤是为了除去


(3)步骤③中无水硫酸镁是
(4)蒸馏除乙醚的过程中采用的加热方式为
(5)提纯产品B 所用到的实验操作为
 (1)下列实验操作或对实验事实的叙述正确的是
(1)下列实验操作或对实验事实的叙述正确的是①用碱式滴定管量取20.00mL 0.10mol/L KMnO4溶液;
②用托盘天平称取10.50g干燥的NaCl固体;
③各放一张质量相同的滤纸于天平的两托盘上,将NaOH体放在左盘纸上称量;
④实验室配制Fe2(SO4)3溶液时,常加入少量的稀硫酸;
⑤中和滴定中,锥形瓶用蒸馏水洗净后可直接往其中注入一定量的待测溶液;
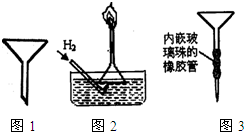
(2)普通漏斗(见图1)是中学化学实验室常用仪器之一,用途很多.
①请举两例说明普通漏斗在化学实验中的运用:
②你是否探讨过在化学实验中创新地使用普通漏斗?请你积极参与到下面的讨论中:
A.图2是某同学实验室制备H2并验证H2有可燃性装置的一部分,请说出他这样做的优点
B.某同学用苯萃取碘水中碘时,找不到分液漏斗.他先在试管中将混合液充分振荡后静置,然后再用普通漏斗和其他常见实验仪器和用品组装成一个简易分液器进行分液(图3),以解燃眉之急.试分析该设计的不足之处