网址:http://m.1010jiajiao.com/timu3_id_37067[举报]
|
设某氨水pH值为x,某稀盐酸的pH值为y,且x+y=14,x>11.如果将上述两溶液分别取出10 mL充分混合后,所得溶液中各种离子浓度由大到小的顺序是 | |
| [ ] | |
A. |
c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
B. |
c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
C. |
c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
D. |
c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
Ⅰ、用”>“、“=’’或“<"符号表示以下各问中量的关系.
(1)pH
相同的氨水、氢氧化钠和氢氧化钡溶液,分别用蒸馏水稀释到原来的X倍、Y倍、Z倍,稀释后三种溶液的pH仍相同,则X、Y、Z之间大小的关系是________.(2)
相同体积、相同物质的量浓度的氨水、氢氧化钠和氢氧化钡三种稀溶液与盐酸完全反应,消耗同浓度的盐酸的体积分别为V1、V2、V3,则三者关系为________.(3)相同温度、相同物质的量浓度的七种溶液:
①H2SO4,
②NaCl,
③NaHSO4,
④CH3COOH,
⑤NH3H2O,
⑤NaOH,
⑦Ba(OH)2.
按
pH由大到小的顺序排列,正确顺序是(填写编号)________Ⅱ、
在一容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的反应.
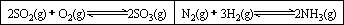
(1)
若起始时左侧投入2 mol SO2、1 mol O2,右侧投入1 mol N2、4 mol H2,达到平衡后,隔板是否可能处于中央位置?________(填“可能”或“不可能”).(2)
若起始时左侧投入2 mol SO2、1 mol O2,右侧投入1 mol N2、2 mol H2,达到平衡后,隔板处于中央位置,则SO2的转化率与N2的转化率之比为________.(3)
若起始时左侧投入2 mol SO2、1 mol O2,右侧投入1 mol N2、a mol H2且起始时右侧体积小于左侧体积,调节反应器至某一温度(两侧温度相同),使平衡时隔板处于中央位置,此时SO2的转化率与N2的转化率之比为5∶1,则a的取值范围为________.下列实验操作或对实验事实的叙述中存在错误的是________(填序号)
A、用50mL酸式滴定管准确量取25.00mL酸性KMnO4溶液,放入锥形瓶中待用
B、在测定硫酸铜晶体的结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量
C、中和热的测定所需的玻璃仪器有烧杯、温度计、量筒
D、实验室中进行的下列实验需水浴加热:①乙酸乙酯的制备②葡萄糖的银镜反应
E、配制1mol?L-1的NaOH溶液时,下列操作会造成所配浓度偏低:①溶解后烧杯未多次洗涤②定容时仰视刻度线③容量瓶中原有少许蒸馏水
F、实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
G、容量瓶检漏:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置数次,观察是否漏水
H、不用其他试剂无法鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4
I、可以用分液漏斗分离下列三组液态混合物:硝基苯和水、油酸和水、乙酸乙酯和乙醇
J、实验室保存少量液溴和白磷常用水封
(2)某研究性学习小组拟用明矾制取Al2(SO4)3晶体和K2SO4晶体.
①实验室除明矾外,已备好的用品有蒸馏水、氨水、pH试纸,还缺少的试剂有________.
②制得Al2(SO4)3与K2SO4物质的量之比小于________.
(3)“磨砂”是增加玻璃仪器密封性的一种处理工艺,可使仪器不漏液或不漏气.在下列仪器中:①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶;⑦酸式滴定管;⑧碱式滴定管,肯定用不到“磨砂”处理的有(填序号).
(4)碱式氯化铜(不溶于水的绿色结晶)是一种农药,化学式为:CuCl2·3Cu(OH)2·xH2O.为验证其组成并确定X值,某学生设计了以下几步实验
①取ag碱式氯化铜的晶体制成粉末.
②将晶体加热至确认质量不再变化为止(铜仍为二价),冷却后称其质量为bg.
③另取ag碱式氯化铜的晶体,溶于足量硝酸中,得到溶液.
④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体,称量为cg.
若以上操作均正确,试回答下列问题:
A、将晶体制成粉末,所用的主要化学仪器是________(填仪器名称).以上四步中,用到玻璃棒的步骤有________(填序号)
B、步骤②灼烧后得到的固体应为:________.
C、步骤④主要包括:加入足量硝酸银溶液→________→________→晾干→称量