网址:http://m.1010jiajiao.com/timu3_id_369924[举报]
(Ⅰ)下列实验操作或对实验事实的描述正确的是 (填序号);
① 实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
② 配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低。
③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④ 实验室用铜片与稀硝酸反应产生的气体可用排水法收集
⑤ 试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
⑥ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑦ 苯与溴水在铁粉的催化作用下制备溴苯
⑧ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
Ⅱ.在中学化学实验中,通常用无水硫酸铜来检验少量水的存在。由于无水硫酸铜吸湿性很强,需要现制现用。
方法甲:取2药匙细小的硫酸铜晶体置于_______中研碎后放入坩埚,将坩埚放在______上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入___________中进行冷却(请选用合适仪器填空:表面皿、研钵、烧杯、通风橱、试管夹、干燥器、泥三角)。
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20 mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5 min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干。
【交流与讨论】
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是_________(用化学方程式表示)。
(2)方法乙中,浓硫酸的作用是__________;为了不浪费药品,对无水乙醇洗涤液进行再生的方法是______ ,所用的主要玻璃仪器有烧瓶、接液管、锥形瓶、酒精灯________________等。
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想______________。
 (4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
【问题一】如图装置中,分液漏斗内装的液体是________,反应结束时,获取CuSO4•5H2O的操作过程是先________________,趁热将三颈瓶中的液体倒入烧杯中冷却,析出晶体CuSO4?5H2O ,过滤、晾干。
【问题二】工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品―― 亚硝酸钙。尾气吸收生成亚硝酸钙的化学方程式是_______________。
查看习题详情和答案>>[探究一]称取无锈铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
(1)甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,请选择下列试剂,设计简单的实验方案(简述操作过程、现象和结论)
供选用试剂:a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
(2)乙同学为了测定气体Y中SO2的含量,设计如下三种方案:
方案Ⅰ.取672mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g.
方案Ⅱ.向VmL c mol?L-1酸性高猛酸钾溶液中缓慢通入Y气体aL(标准状况),溶液恰好完全褪色.
方案Ⅲ,取VL(标准状况)气体Y缓慢通入足量的氢氧化钡溶液中,充分反应后,过滤、洗涤、烘干,称得固体质量为mg.
①其中不合理的方案是
②选择合理方案的数据计算气体Y中SO2的体积分数(用含未知数的代数式表示)
| 7cV |
| 125a |
| 7cV |
| 125a |
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体.为此设计了下列探究实验装置(图中夹持装置已省略).
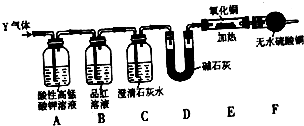
(3)装置A中试剂的作用是
(4)简述确认气体Y中含有CO2的实验现象:
(5)有同学根据“F干燥管无水硫酸铜是否变蓝色”确认Y气体中是否有氢气,你认为是否可靠?
a取少量待测液,仔细观察,呈无色;
b向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解.实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝.
据此可以判断该待测液中一定含有的阳离子是______,一定没有的阳离子是______.还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称)______,现象是______.
(2)溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色.某同学在探究铁的化合物的相互转化时,进行了如下实验.请你参与讨论.
实验操作:向20mL的FeSO4溶液中,滴加浓溴水,振荡.
实验现象:溶液由浅绿色(近乎无色)变成黄色.
a溶液颜色发生改变的原因可能是______(用选项符号表示).
①使溶液呈黄色的微粒是Br2
②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
b为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
| 操作 | 实验现象及结论 | |
| 方案1 | 取少量黄色溶液,加入NaOH | 最终生成红褐色沉淀,说明溴水和FeSO4溶液发生了化学反应 |
| 方案2 | 取少量黄色溶液,加入淀粉碘化钾溶液 | 溶液变蓝色,说明未发生化学反应 |
| 方案3 | 取少量黄色溶液,加入四氯化碳,振荡 | 下层溶液呈橙红色,说明未发生化学反应 |
②方案2的结论明显不合理,可能发生反应的离子方程式为______.
③方案3的结论也不合理,理由是______.
④你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):______.
查看习题详情和答案>>
(1)某待测液中可能含有A13+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:
a取少量待测液,仔细观察,呈无色;
b向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解.实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝.
据此可以判断该待测液中一定含有的阳离子是______,一定没有的阳离子是______.还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称)______,现象是______.
(2)溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色.某同学在探究铁的化合物的相互转化时,进行了如下实验.请你参与讨论.
实验操作:向20mL的FeSO4溶液中,滴加浓溴水,振荡.
实验现象:溶液由浅绿色(近乎无色)变成黄色.
a溶液颜色发生改变的原因可能是______(用选项符号表示).
①使溶液呈黄色的微粒是Br2
②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
b为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
| 操作 | 实验现象及结论 | |
| 方案1 | 取少量黄色溶液,加入NaOH | 最终生成红褐色沉淀,说明溴水和FeSO4溶液发生了化学反应 |
| 方案2 | 取少量黄色溶液,加入淀粉碘化钾溶液 | 溶液变蓝色,说明未发生化学反应 |
| 方案3 | 取少量黄色溶液,加入四氯化碳,振荡 | 下层溶液呈橙红色,说明未发生化学反应 |
②方案2的结论明显不合理,可能发生反应的离子方程式为______.
③方案3的结论也不合理,理由是______.
④你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):______. 查看习题详情和答案>>