网址:http://m.1010jiajiao.com/timu3_id_36945[举报]
(4分)已知25 ℃时,0.1mol/L醋酸溶液的pH约为3,向其中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大,对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的____________(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(2)若乙的解释正确,溶液的pH应__________(填“增大”“减小”或“不变”)。(已知25 ℃时,NH3·H2O的Kb=1.8×10-5,CH3COOH的Ka=1.8×10-5)
查看习题详情和答案>>
甲同学认为醋酸钠水解溶液呈碱性,增大了c(OH-),因而溶液的pH增大。
乙同学认为醋酸钠溶于水电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)上述两种解释中______________(填“甲”或“乙”)正确。
(2)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L醋酸溶液中加入少量下列物质中的______________(填写编号),然后测定溶液的pH。
A.固体CH3COOK
B.固体CH3COONH4
C.气体NH3
D.固体NaHCO3
(3)若_____________(填“甲”或“乙”)的解释正确,溶液的pH应____________(填“增大”、“减小”或“不变”)(已知25℃时,CH3COONH4溶液呈中性)。
(4)常温下将0.010molCH3COONa和0.004molHCl溶于水,配置成0.5L混合溶液,判断:
①溶液中共有____________种粒子;
②溶液中有两种粒子的物质的量之和一定等于0.010mol,它们是______________和___________;
③溶液中n(CH3COO-)+n(OH-)-n(H+)=____mol。
甲同学认为醋酸钠水解溶液呈碱性,增大了c(OH-),因而溶液的pH增大。
乙同学认为醋酸钠溶于水电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)上述两种解释中______________(填“甲”或“乙”)正确。
(2)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L醋酸溶液中加入少量下列物质中的______________(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(3)若_____________(填“甲”或“乙”)的解释正确,溶液的pH应____________(填“增大”、“减小”或“不变”)(已知25℃时,CH3COONH4溶液呈中性)。
(4)常温下将0.010molCH3COONa和0.004molHCl溶于水,配置成0.5L混合溶液,判断:
①溶液中共有____________种粒子;
②溶液中有两种粒子的物质的量之和一定等于0.010mol,它们是______________和___________;
③溶液中n(CH3COO-)+n(OH-)-n(H+)=____mol。 查看习题详情和答案>>
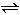 CH3COOH+OH-而使溶液呈碱性。
CH3COOH+OH-而使溶液呈碱性。现有25℃时的0.1mol/L醋酸溶液,其pH约为3,向其中加入少量醋酸钠晶体并使之溶解后,发现溶液的pH增大。对此,有两种不同的解释:
甲同学认为,醋酸钠水解后呈碱性,增大了c(OH-),故而溶液的pH增大;
乙同学认为,醋酸钠溶于水后电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,故而溶液的pH增大。
(1)根据中学所学知识,你认为上述解释中哪一种正确?简述你的理由。
(2)请从固体NaOH、固体NaHCO3、固体CH3COONH4、固体NH4Cl中选择一种试剂,设计一个简单的实验,用以证明上述哪种解释合理。 查看习题详情和答案>>
已知在25℃时0.1mol/L醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)上述两种解释中 正确(填“甲”或“乙”)
(2)为了验证上述哪种解释正确,继续做如下实验:向0.1mol/L醋酸溶液中加入少量下列物质中的 (填写编号),然后测定溶液的pH。
A、固体CH3COOK B、固体CH3COONH4 C、气体NH3 D、固体NaHCO3
(3)若 (填“甲”或“乙”)的解释正确,溶液中的pH应 (填“增大”“减小”或“不变”)。
(4)常温下将0.010molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断:
①溶液中共有 种粒子。
②溶液中有两种粒子的物质的量之和一定等于0.010mol,它们是 。
③溶液中n(CH3COO-)+n(OH-)-n(H+)= mol。
查看习题详情和答案>>