摘要:pH值相同的盐酸溶液和醋酸溶液分别与锌反应.若最后锌都全部溶解.且放出的气体一样多.则下列判断中正确的是 A.整个反应阶段的平均反应速率:醋酸>盐酸 B.反应所需的时间:盐酸<醋酸 C.开始时的反应速率:盐酸>醋酸 D.参加反应的锌的质量:盐酸=醋酸
网址:http://m.1010jiajiao.com/timu3_id_36938[举报]
某温度下, pH值相同的盐酸和醋酸溶液分别稀释,平衡pH值随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是
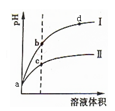
- A.曲线Ⅰ为醋酸稀释时pH值变化曲线
- B.b点溶液中水的电离程度比c点溶液中水的电离程度大
- C.a点时,加入相同大小的锌粒,与盐酸反应的速率大
- D.加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的多
现有pH值与体积相同的盐酸(A)和醋酸(B),分别向其中加锌片,最后有一种溶液中锌有剩余,且放出的H2一样多.则下面的判断正确的是
[ ]
A.刚开始反应时的速率A>B
B.参加反应的锌的质量A>B
C.盛盐酸的溶液中锌的剩余
D.整个反应的平均速率B>A
查看习题详情和答案>>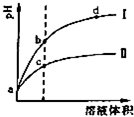 常温下,将PH值和体积都相同的盐酸和醋酸溶液分别加蒸馏水稀释,PH但随溶液体 积变化如图,下列有关叙述正确的是( )
常温下,将PH值和体积都相同的盐酸和醋酸溶液分别加蒸馏水稀释,PH但随溶液体 积变化如图,下列有关叙述正确的是( )