摘要:22] 3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O 9 +12HCl=5Fe(NO3)3+4FeCl3+3NO↑+6H2O [铁升1,氮降3,生成1molNO,参加反应的Fe(NO3)2为3mol,余下观察法] Fe(NO3)2既是氧化剂又是还原剂 由绿色变为黄色
网址:http://m.1010jiajiao.com/timu3_id_36910[举报]
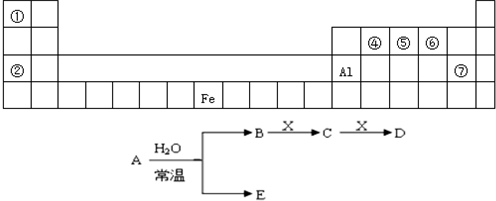
下表是元素周期表的一部分,A、B、C、D、E、X是下表中给出元素组成的常见单质或化合物.

已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)

(1)若E为单质气体,D为白色沉淀,A的化学式可能是
(2)若E为氧化物,则A与水反应的化学方程式为
①当X是碱性盐溶液,C分子中有22个电子时,则C的结构式为
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式
查看习题详情和答案>>

已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)

(1)若E为单质气体,D为白色沉淀,A的化学式可能是
Na、Na2O2
Na、Na2O2
,C与X反应的离子方程式为3AlO2-+Al3++6H2O═4Al(OH)3↓
3AlO2-+Al3++6H2O═4Al(OH)3↓
.(2)若E为氧化物,则A与水反应的化学方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
.①当X是碱性盐溶液,C分子中有22个电子时,则C的结构式为
O=C=O
O=C=O
,表示X呈碱性的离子方程式为CO32-+H2O?HCO3-+OH-,
CO32-+H2O?HCO3-+OH-,
.②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为
3Fe+8H++2NO3-═2Fe3++2NO↑+4H2O
3Fe+8H++2NO3-═2Fe3++2NO↑+4H2O
.(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式
CO+H2O
CO2+H2
| 高温 |
CO+H2O
CO2+H2
.t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的平衡常数K=1,D的转化率为| 高温 |
50%
50%
.图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
(1)若E为氧化物,则A与水反应的化学方程式为
①当X是碱性盐溶液,C分子中有22个电子时,表示X呈碱性的离子方程式为
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为
(2)若E为单质气体,D为白色沉淀,A的化学式可能是
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,则该可逆反应的化学方程式为
查看习题详情和答案>>

(1)若E为氧化物,则A与水反应的化学方程式为
3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
,该反应中氧化剂和还原剂的物质的量之比为1:2
1:2
.①当X是碱性盐溶液,C分子中有22个电子时,表示X呈碱性的离子方程式为
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
.②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为
3Fe+8H++2NO3-═2Fe3++2NO↑+4H2O
3Fe+8H++2NO3-═2Fe3++2NO↑+4H2O
.(2)若E为单质气体,D为白色沉淀,A的化学式可能是
Na、Na2O2等
Na、Na2O2等
,B含有的化学键类型为离子键、共价键
离子键、共价键
,C与X反应的离子方程式为3AlO2-+Al3++6H2O═4Al(OH)3↓
3AlO2-+Al3++6H2O═4Al(OH)3↓
.(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,则该可逆反应的化学方程式为
CO+H2O
CO2+H2
| 高温 |
CO+H2O
CO2+H2
.| 高温 |
(2009?泰安模拟)为探索工业含铝、铁、铜合金废料的再利用,某同学设计的实验方案如下:

请回答:
(1)操作①用到的玻璃仪器有
(2)写出反应①的化学方程式
反应②的离子方程式
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是
(5)将滤渣B的均匀混合物平均分成四等份,每份13.2g,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO).
试通过计算填空:
①写出实验①中发生反应的离子方程式
②实验④中V=
查看习题详情和答案>>

请回答:
(1)操作①用到的玻璃仪器有
烧杯、漏斗、玻璃棒
烧杯、漏斗、玻璃棒
;(2)写出反应①的化学方程式
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
;反应②的离子方程式
[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-
[Al(OH)4]-+CO2═Al(OH)3↓+HCO3-
;(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选)
取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色
取少量滤液D加入NaOH溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色
;(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是
Cu+H2O2+H2SO4+3H2O=CuSO4?5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O
Cu+H2O2+H2SO4+3H2O=CuSO4?5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O
;(5)将滤渣B的均匀混合物平均分成四等份,每份13.2g,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO).
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属质量/g | 9.0 | 4.8 | 0 | 0 |
| NO体积/L | 1.12 | 2.24 | 3.36 | V |
①写出实验①中发生反应的离子方程式
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
;②实验④中V=
4.48L
4.48L
.