摘要:17. 乙二酸俗称草酸.在生产和科学实验中有广泛的用途. (1)测定某未知浓度的KMnO4溶液.可用草酸作还原剂.估计需用0.50mol/L的草酸溶液90mL.则用草酸晶体(H2C2O4·2H2O)配制溶液时.所用的定量玻璃仪器是 ,如果在定容时视线偏高.则所测得KMnO4溶液的浓度将 (填“偏大 .“偏小 或“不变 ).滴定时的反应原理可简单表示为: H2C2O4+ MnO4- → CO2↑+ Mn2+ 则滴定终点时的颜色变化为: . (2)乙二酸其主要物理常数如下: 名称 分子式 颜色.状态 溶解性(g) 熔点(℃) 分解温度 乙二酸 H2C2O4 无色固体 8.6 182.0 175℃ 二水合乙二酸 H2C2O4·2H2O 无色晶体 -- 101.1 ―― 右图是教材上的一个实验装置图.观察装置判断 进行该实验的目的是 . 根据上述材料提供的信息.请指出该实验装置的 不合理之处.说明理由. .
网址:http://m.1010jiajiao.com/timu3_id_368781[举报]
乙二酸(HOOC-COOH)俗名草酸,易溶于水,属于二元中强酸,生产和科学实验中有着广泛的用途.草酸晶体的组成可用H2C2O4?xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol?L-1的KMnO4溶液滴定,
(1)将所发生的反应方程式完成并配平,将完整的化学方程式写在答题卡上.
KMnO4+H2C2O4+
(2)整个实验过程中不需要的仪器有
a.托盘天平(带砝码,镊子)b.酸式滴定管 c.烧瓶 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶
h.玻璃棒 i.药匙
(3)实验中,标准KMnO4溶液应盛装在
(4)在滴定过程中若用去amol?L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为
-5
-5.(用含W、a、V的代数式表示)
(5)该小组同学将0.02mol草酸晶体(H2C2O4?2H2O)加入到100mL0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为
查看习题详情和答案>>
(1)将所发生的反应方程式完成并配平,将完整的化学方程式写在答题卡上.
KMnO4+H2C2O4+
3H2SO4
3H2SO4
═K2SO4+CO2↑+MnSO4+8H2O
8H2O
(2)整个实验过程中不需要的仪器有
c,f
c,f
(填序号).a.托盘天平(带砝码,镊子)b.酸式滴定管 c.烧瓶 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶
h.玻璃棒 i.药匙
(3)实验中,标准KMnO4溶液应盛装在
酸
酸
式滴定管中.滴定终点时溶液的颜色变化为酸溶液由无色变为浅紫色且半分钟不褪色
酸溶液由无色变为浅紫色且半分钟不褪色
.(4)在滴定过程中若用去amol?L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为
0.1aV
0.1aV
mol?L-1,由此可计算x的值是| 50w |
| 9av |
| 50w |
| 9av |
(5)该小组同学将0.02mol草酸晶体(H2C2O4?2H2O)加入到100mL0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为
C(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
C(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
.乙二酸(HOOC-COOH)俗名草酸,易溶于水,属于二元中强酸,生产和科学实验中有着广泛的用途.草酸晶体的组成可用H2C2O4-xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol-L-1的KMnO4溶液滴定,
(1)将所发生的反应方程式完成并配平,将完整的化学方程式写在答题卡上.
KMnO4+H2C2O4+______═K2SO4+CO2↑+MnSO4+______
(2)整个实验过程中不需要的仪器有______(填序号).
a.托盘天平(带砝码,镊子)b.酸式滴定管 c.烧瓶 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶
h.玻璃棒 i.药匙
(3)实验中,标准KMnO4溶液应盛装在______式滴定管中.滴定终点时溶液的颜色变化为______.
(4)在滴定过程中若用去amol-L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为______mol-L-1,由此可计算x的值是______.(用含W、a、V的代数式表示)
(5)该小组同学将0.02mol草酸晶体(H2C2O4-2H2O)加入到100mL0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为______.
查看习题详情和答案>>
(1)将所发生的反应方程式完成并配平,将完整的化学方程式写在答题卡上.
KMnO4+H2C2O4+______═K2SO4+CO2↑+MnSO4+______
(2)整个实验过程中不需要的仪器有______(填序号).
a.托盘天平(带砝码,镊子)b.酸式滴定管 c.烧瓶 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶
h.玻璃棒 i.药匙
(3)实验中,标准KMnO4溶液应盛装在______式滴定管中.滴定终点时溶液的颜色变化为______.
(4)在滴定过程中若用去amol-L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为______mol-L-1,由此可计算x的值是______.(用含W、a、V的代数式表示)
(5)该小组同学将0.02mol草酸晶体(H2C2O4-2H2O)加入到100mL0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为______.
乙二酸(HOOC-COOH)俗名草酸,易溶于水,属于二元中强酸,生产和科学实验中有着广泛的用途.草酸晶体的组成可用H2C2O4?xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol?L-1的KMnO4溶液滴定,
(1)将所发生的反应方程式完成并配平,将完整的化学方程式写在答题卡上.
KMnO4+H2C2O4+ ═K2SO4+CO2↑+MnSO4+
(2)整个实验过程中不需要的仪器有 (填序号).
a.托盘天平(带砝码,镊子)b.酸式滴定管 c.烧瓶 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶
h.玻璃棒 i.药匙
(3)实验中,标准KMnO4溶液应盛装在 式滴定管中.滴定终点时溶液的颜色变化为 .
(4)在滴定过程中若用去amol?L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为 mol?L-1,由此可计算x的值是 .(用含W、a、V的代数式表示)
(5)该小组同学将0.02mol草酸晶体加入到100mL0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为 . 查看习题详情和答案>>
(1)将所发生的反应方程式完成并配平,将完整的化学方程式写在答题卡上.
KMnO4+H2C2O4+ ═K2SO4+CO2↑+MnSO4+
(2)整个实验过程中不需要的仪器有 (填序号).
a.托盘天平(带砝码,镊子)b.酸式滴定管 c.烧瓶 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶
h.玻璃棒 i.药匙
(3)实验中,标准KMnO4溶液应盛装在 式滴定管中.滴定终点时溶液的颜色变化为 .
(4)在滴定过程中若用去amol?L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为 mol?L-1,由此可计算x的值是 .(用含W、a、V的代数式表示)
(5)该小组同学将0.02mol草酸晶体加入到100mL0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为 . 查看习题详情和答案>>
某学生设计了以下验证乙二酸(HOOC—COOH)(俗称草酸)的一些性质的实验,根据实验回答下列问题:
(1)用pH值试纸验证乙二酸的酸性,其操作步骤是: 。
(2)已知:草酸在175℃时受热分解可生成H2O、![]() 和CO;
和CO;
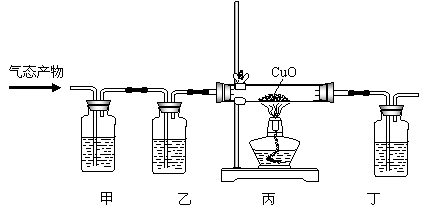
Ⅰ.该学生设计了下图实验装置,来证明草酸分解产物中有CO并证明其氧化产物。回答有关问题:
|
|
①上述实验装置中三个洗气瓶分别盛有澄清石灰水、氢氧化钠溶液、浓硫酸,则甲应盛 ,乙应盛 ;
②丙中玻璃管中的现象为: ;
③丁装置作用是 。
Ⅱ.在实验过程中,该学生发现应对上述实验装置进行一些改进,才能保证实验的科学性和安全性(所选装置如下图)。请回答下列问题:
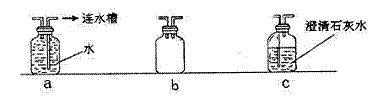
①为确证通往玻璃管的CO气体中已除去CO2,可在甲和乙之间连接 。(填上面装置序号)
②在装置丙和丁之间连接b装置,其作用是 。
③从环境保护的角度看,应增加尾气处理装置,你如何进行尾气处理 ,
查看习题详情和答案>>某学生设计了以下验证乙二酸(HOOC—COOH)(俗称草酸)的一些性质的实验,根据实验回答下列问题:
(1)用pH值试纸验证乙二酸的酸性,其操作步骤是: 。
(2)已知:草酸在175℃时受热分解可生成H2O、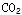 和CO;
和CO;
Ⅰ.该学生设计了下图实验装置,来证明草酸分解产物中有CO并证明其氧化产物。回答有关问题:
①上述实验装置中三个洗气瓶分别盛有澄清石灰水、氢氧化钠溶液、浓硫酸,则甲应盛 ,乙应盛 ;
②丙中玻璃管中的现象为: ;
③丁装置作用是 。
Ⅱ.在实验过程中,该学生发现应对上述实验装置进行一些改进,才能保证实验的科学性和安全性(所选装置如下图)。请回答下列问题:
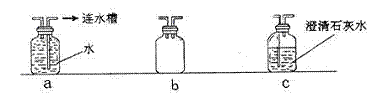
①为确证通往玻璃管的CO气体中已除去CO2,可在甲和乙之间连接 。(填上面装置序号)
②在装置丙和丁之间连接b装置,其作用是 。
③从环境保护的角度看,应增加尾气处理装置,你如何进行尾气处理 ,
(1)用pH值试纸验证乙二酸的酸性,其操作步骤是: 。
(2)已知:草酸在175℃时受热分解可生成H2O、
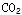 和CO;
和CO;Ⅰ.该学生设计了下图实验装置,来证明草酸分解产物中有CO并证明其氧化产物。回答有关问题:
| | |
| | 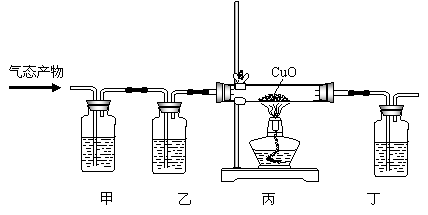 |
①上述实验装置中三个洗气瓶分别盛有澄清石灰水、氢氧化钠溶液、浓硫酸,则甲应盛 ,乙应盛 ;
②丙中玻璃管中的现象为: ;
③丁装置作用是 。
Ⅱ.在实验过程中,该学生发现应对上述实验装置进行一些改进,才能保证实验的科学性和安全性(所选装置如下图)。请回答下列问题:

①为确证通往玻璃管的CO气体中已除去CO2,可在甲和乙之间连接 。(填上面装置序号)
②在装置丙和丁之间连接b装置,其作用是 。
③从环境保护的角度看,应增加尾气处理装置,你如何进行尾气处理 ,