摘要:25. (1)镉在元素周期表中第 5 周期.第 ⅡB 族. (2)写出步骤①反应的离子方程式 Cd+2H+=Cd2++H2↑.Zn+2H+=Zn2++H2↑(各1分.共2分) (3)步骤②所加入的金属的名称是 锌 .如何处理“溶液 ? 回收炼锌 . (4)镉在 阴 极析出.该电极材料是 镉板 (5)写出硫化钠沉淀镉离子的离子方程 Cd2++S2-=CdS↓ . 26 (1)热化学方程式是N2H4(1)+O2(g)=N2(g)+2H2O,△H=-624kJ/mol(2分) (2)①锌片上发生的电极反应是Cu2++2e-=Cu ②标准状况下的空气 112 L (3)该反应的离子方程式是 ClO-+2NH3=N2H4+Cl-+H2O . (4)1阴极的电极反应式为 N2+6H++6e-==2NH3 .
网址:http://m.1010jiajiao.com/timu3_id_368707[举报]
X、Y是元素周期表前20号元素,且X的原子序数比Y大4.请填空:
Ⅰ.若X是金属元素,Y是非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂.
(1)元素Y的原子结构示意图为 .
(2)含X的某盐与Y的气态氧化物都能作漂白剂,实验室保存该盐的方法是 .
Ⅱ.若X、Y同为第三周期元素,Y的离子半径在该周期离子中最小.
(3)乙烯与X单质反应的反应类型为 .
(4)广西治理龙江河镉(Cd2+)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入X、Y形成的一种常见化合物,该化合物的作用是 (用必要的离子方程式和文字解释).
Ⅲ.若X是短周期最活泼的金属元素.
(5)Y2H4、O2与XOH溶液组成的电池,其负极的电极反应式(已知:Y2H4可以和O2反应生成Y2和H2O)为 .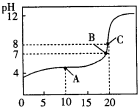
(6)25℃,用0.1000mol?L-1 XOH溶液滴定20.00mL0.1000mol?L-1某一元酸HA溶液所得滴定曲线如图.
①A、B、C三点所示溶液导电能力由强到弱顺序为 .
②估算25℃时HA的电离常数为 .
查看习题详情和答案>>
Ⅰ.若X是金属元素,Y是非金属元素,X的氧化物、氯化物都是实验室常用的干燥剂.
(1)元素Y的原子结构示意图为
(2)含X的某盐与Y的气态氧化物都能作漂白剂,实验室保存该盐的方法是
Ⅱ.若X、Y同为第三周期元素,Y的离子半径在该周期离子中最小.
(3)乙烯与X单质反应的反应类型为
(4)广西治理龙江河镉(Cd2+)污染时,先向河中投入沉淀剂将Cd2+转化为难溶物,再投入X、Y形成的一种常见化合物,该化合物的作用是
Ⅲ.若X是短周期最活泼的金属元素.
(5)Y2H4、O2与XOH溶液组成的电池,其负极的电极反应式(已知:Y2H4可以和O2反应生成Y2和H2O)为

(6)25℃,用0.1000mol?L-1 XOH溶液滴定20.00mL0.1000mol?L-1某一元酸HA溶液所得滴定曲线如图.
①A、B、C三点所示溶液导电能力由强到弱顺序为
②估算25℃时HA的电离常数为
 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大 的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E20和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如右图所示.请回答下列问题.
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大 的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E20和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如右图所示.请回答下列问题.
(1)E元素原子基态时的电子排布式为 .
(2)A2F分子中F原子的杂化类型是
(3)CA3极易溶于水,其原因主要是 ,
 (4)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途.富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为 ;1 molC60分子中σ键的数目为 .
(4)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途.富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为 ;1 molC60分子中σ键的数目为 .
(5)多元化合物薄膜太阳能电池材料为无机盐,其主要包括
砷化镓、硫化镉、硫化锌及铜铟硒薄膜电池等.
①第一电离能:As Se(填“>”“<”或“=”).
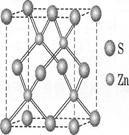
②硫化锌的晶胞中(结构如下图所示),硫离子的配位数
是 与S距离最近且等距离的S之间的距离为
(密度为ρg/cm3)
③二氧化硒分子的空间构型为 .
查看习题详情和答案>>