网址:http://m.1010jiajiao.com/timu3_id_368344[举报]
|
如下三个热化学方程式:
关于以上三个热化学方程式的表述中正解的是 ①它们都是放热反应 ②a、b、c均增为正值 ③a=b ④b>a ⑤2b=c | |
| [ ] | |
A. |
①④⑤ |
B. |
①②④ |
C. |
①②③ |
D. |
①⑤ |
H2(g)+![]() O2(g)====H2O(g) △H=a kJ·mol-1
O2(g)====H2O(g) △H=a kJ·mol-1
H2(g)+![]() O2(g)====H2O(1) △H=b kJ·mol-1
O2(g)====H2O(1) △H=b kJ·mol-1
2H2(g)+O2(g)====2H2O(1) △H=c kJ·mol-1
关于以上三个热化学方程式的表述中正确的是( )
①它们都是放热反应 ②a、b、c均为正值 ③a=b ④b>a ⑤2b=c
A.①④⑤ B.①②④ C.①②③ D.①⑤
查看习题详情和答案>>如下三个热化学方程式:
H2(g)+![]() (g)H2O(g) △H=a kJ?mol-1
(g)H2O(g) △H=a kJ?mol-1
H2(g)+![]() (g)H2O(l) △H=b kJ?mol-1
(g)H2O(l) △H=b kJ?mol-1
2H2(g)+O2(g)2H2O(l) △H=c kJ?mol-1
关于以上三个热化学方程式的表述中正确的是( )
①它们都是放热反应 ②a、b、c均为正值
③a=b ④b>a ⑤2b=c
A.①④⑤ B.①②④ C.①②③ D.①⑤
查看习题详情和答案>>
| |||||||||||||||||||||||||||||
某课外活动小组对一氧化碳还原氧化铁的实验中最后的产物产生浓厚的兴趣,试通过实验来探究其成分。
Ⅰ.实验装置:
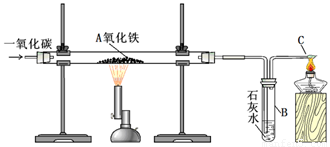
用一氧化碳还原氧化铁的实验装置
该装置B中发生的离子方程式是
装置B的作用是
Ⅱ.实验现象:玻璃管A中的粉末由红色逐渐变为黑色时,停止加热,继续通一氧化碳,冷却到室温,停止通气,同时观察到澄清的石灰水变浑浊。
Ⅲ.实验结论:
甲认为:依据上述实验现象可以判断出生成的黑色固体为金属铁。
乙认为:仅从上述实验现象,不足以证明生成的黑色固体为金属铁,她增加了一个实验:用磁铁靠近生成的黑色固体,看到有黑色固体被磁铁吸引。于是得出生成的黑色固体为金属铁的结论。
请你通过该反应的相关资料对他们结论作出判断并通过实验检验其合理性:
(1)在一定条件下:一氧化碳与氧化铁在加热条件下,可发生如下反应
3Fe2O3+CO 2Fe3O4+CO2
2Fe3O4+CO2
Fe3O4+4CO 4Fe+4CO2
4Fe+4CO2
(2)四氧化三铁(Fe3O4)为黑色固体,有强磁性,能够被磁铁吸引。
甲、乙同学的结论: 你对此评价的理由是:
Ⅳ.实验探究
对反应后固体成分提出假设:
假设1:反应后固体中只有Fe;
假设2:反应后固体中只有Fe3O4;
假设3:反应后固体中__ _____________________
为确定实验中最后的产物的成分,丙同学设计如下实验,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置。
限选试剂和仪器: 1mol/LCuSO4 、0.01mol/L KSCN溶液、1mol/L盐酸、0.01mol/L氯水、试管、玻璃棒、胶头滴管。
|
实验操作 |
预期现象和结论 |
|
步骤一:取硬质玻璃管中固体产物少量分别于A、B试管中,加入足量1mol/LCuSO4溶液、搅拌溶解。 |
(1)若A试管中黑色固体不溶解,并且没有观察到其他现象,则黑色固体为 (2)若B试管中有红色固体析出,则说明黑色固体中含有Fe。 |
|
步骤二:对试管B中溶液过滤,将所得固体洗涤干净后,加足量1mol/L盐酸后,再依次分别加入适量0.01mol/L氯水、少量0.01mol/L KSCN溶液 |
(1)若溶液不变红色,则
(2)若溶液变红色,则
|
Ⅴ.延伸探究:丁同学试图通过反应前后固体质量的变化来确定黑色固体的成分,你认为可行吗?(假设氧化铁在反应中完全反应) (填“行”或“不行”)理由是 。
查看习题详情和答案>>