网址:http://m.1010jiajiao.com/timu3_id_36787[举报]
(1)取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为
(2)已知2CuFeS2+4O2
| 800℃ |
假定各步反应都完全,完成下列计算:
①由6mol CuFeS2生成6mol Cu,求消耗O2的物质的量
②6mol CuFeS2和14.25mol O2反应,理论上可得到
③6mol CuFeS2和15.75mol O2反应,理论上可得到
现代社会中铜在不同领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
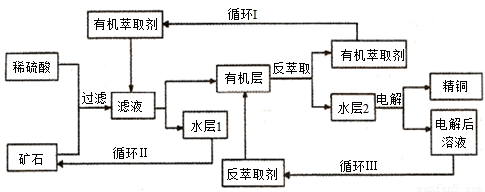
已知:反萃取后的水层2是硫酸铜溶液。回答下列问题:
(1)矿石用稀硫酸处理过程中发生多步反应,除了发生Cu2O+2H+=Cu2++Cu+H2O和Fe2O3+6H+=2Fe3++3H2O反应外,其它反应的离子方程式为____________________________________________。
(2)检验滤液中是否含有Fe3+的方法是____________________________________________________。
(3)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐,若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层l暴露在空气中发生反应的离子方程式________ _____________。
(4)写出电解过程中阳极(惰性电极)发生反应的电极反应式 __________________。
(5)“循环Ⅲ”中反萃取剂的主要成分的化学式是________________。
(6) 黄铜矿(主要成分CuFeS2)是提取铜的主要原料,可采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应:Cu2S+2Cu2O=6Cu+SO2↑。该反应中,_______ (填化学式)作还原剂,每生成1mol Cu,反应中转移电子的物质的量为____________。
查看习题详情和答案>>
(1)利用化学反应可以制备许多物质。实验室用铜制备NO2的离子方程式为_____________ ______。
(2)工业上,黄铜矿(主要成分CuFeS2)是提取铜的主要原料,可采用火法溶炼工艺生产铜,该工艺的中间过程会发生反应:Cu2S+2Cu2O===6Cu+SO2↑。该反应中还原剂为_______ (填化学式),每生成1mol Cu,反应中转移电子的物质的量为___________。
黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。 ②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。 据以上信息回答下列问题:
a.通过上述②,炉渣中的Al2O3变成了 (写离子)。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 酸性KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
查看习题详情和答案>>
(1)取12.5 g黄铜矿样品,经测定含3.60 g硫(杂质不含硫),矿样中CuFeS2含量为 。
(2)已知2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(炉渣)
Cu2S+3SO2+2FeO(炉渣)
产物Cu2S在1200℃高温下继续反应:
2Cu2S+3O2===2Cu2O+2SO2
2Cu2O+Cu2S===6Cu+SO2
假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量。
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到多少摩尔铜。
③6 mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜。
查看习题详情和答案>>黄铜矿(主要成分CuFeS2)是提取铜的主要原料
(1)取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为
(2)已知
产物Cu2S在1200℃高温下班继续反应:
2Cu2S + 3 O2 → 2Cu2O + 2 SO2
2 Cu2O + Cu2S → 6Cu + SO2
假定各步反应都完全,完成下列计算:
① 由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到多少摩尔铜
③6 mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜
查看习题详情和答案>>