摘要:00mLB溶液中过量的HCl:n(HCl)=0.003000mol , 100mLB溶液中过量的HCl:n(HCl)=0.01500mol那么与NH3反应的n(HCl)=0.01000mol 故0.5010g样品中 n(NH3)=0.01000mol n(N)=0.01000mol [Co(NH3)xCly]Clz中氮元素的质量分数 ⑵ I2+2Na2S2O3==2NaI+Na2S4O6 因反应用去0.1000mol·L-1Na2S2O3溶液20.00mL.推算出:n(I2)=0.001000mol Co与Fe同一族.Com+具有强氧化性.故设m=3 则有:2Co3++2I-==2Co2++I2 n(Co3+)=0.002000mol
网址:http://m.1010jiajiao.com/timu3_id_367681[举报]
(2011?浦东新区一模)(1)水作为反应物可与许多化合物发生非氧化还原反应,其中最基本的类型有:
a.化合反应,如(用化学反应方程式表示):
b.
(2)水也能参与许多氧化还原反应,如它与氢化钠(含H-)的反应.写出NaH与水反应的离子方程式.
(3)写出溶液中少量NH4HCO3与过量NaOH反应的离子方程式.
写出溶液中过量NH4HCO3与少量NaOH反应的离子方程式.
查看习题详情和答案>>
a.化合反应,如(用化学反应方程式表示):
CaO+H2O═Ca(OH)2
CaO+H2O═Ca(OH)2
;b.
水解
水解
反应,如(用化学(或离子)反应方程式表示):NH4++H2O?NH3H2O+H+
NH4++H2O?NH3H2O+H+
;(2)水也能参与许多氧化还原反应,如它与氢化钠(含H-)的反应.写出NaH与水反应的离子方程式.
H-+H2O═H2↑+OH-
H-+H2O═H2↑+OH-
;(3)写出溶液中少量NH4HCO3与过量NaOH反应的离子方程式.
NH4++2OH-+HCO3-═NH3↑+H2O+CO32-
NH4++2OH-+HCO3-═NH3↑+H2O+CO32-
;写出溶液中过量NH4HCO3与少量NaOH反应的离子方程式.
OH-+HCO3-═H2O+CO32-
OH-+HCO3-═H2O+CO32-
.现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SOO42-、NOO3-的相互分离.相应的实验过程可用如图表示:
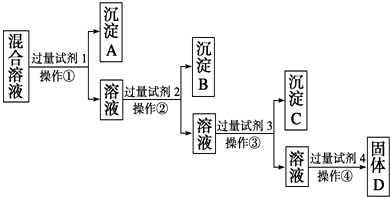
(1)写出上述实验过程中所用试剂的名称:试剂1为
(2)控制试剂4的加入量的方法是
(3)加入过量试剂3的目的是
(4)操作①的名称是
(5)写出加入试剂4后发生反应的化学方程式:
查看习题详情和答案>>

(1)写出上述实验过程中所用试剂的名称:试剂1为
氯化钡溶液(或硝酸钡溶液)
氯化钡溶液(或硝酸钡溶液)
,试剂2为硝酸银溶液
硝酸银溶液
.(2)控制试剂4的加入量的方法是
测定溶液的pH
测定溶液的pH
.(3)加入过量试剂3的目的是
除去溶液中过量的Ba2+、Ag+
除去溶液中过量的Ba2+、Ag+
.(4)操作①的名称是
过滤
过滤
,在加入试剂4后,获得固体D的实验操作④是加热蒸发、冷却结晶、过滤
加热蒸发、冷却结晶、过滤
(填操作名称).(5)写出加入试剂4后发生反应的化学方程式:
Na2CO3+2HNO3═2NaNO3+CO2↑+H2O
Na2CO3+2HNO3═2NaNO3+CO2↑+H2O
.下列各组物质相互混合反应,既有气体生成最终又有沉淀生成的是( )
①金属钠投入FeCl3溶液中
②过量的NaOH溶液和明矾溶液
③少量的电石加到过量的NaHCO3溶液中
④Na2O2投入FeCl2溶液中
⑤浓硫酸铵溶液加入到浓氢氧化钡中.
①金属钠投入FeCl3溶液中
②过量的NaOH溶液和明矾溶液
③少量的电石加到过量的NaHCO3溶液中
④Na2O2投入FeCl2溶液中
⑤浓硫酸铵溶液加入到浓氢氧化钡中.
| A、①④ | B、②③ | C、①③④⑤ | D、①③④ |
环保检测中,有害气体的浓度常用1L有害气体的毫克值(mg/L)来表示,如对某气体样品中所含一氧化碳的浓度进行测定,其方法和实验步骤如下:
①首先将2.00L的气体样品通过盛有I2O5固体的加热管,反应后生成CO2和I2;
②用30.0mL 5.00×10-3mol/L的硫代硫酸钠溶液吸收所产生的碘,发生的反应为:I2+2S2O32-=2I-+S4O62-
③将②中溶液取出1/5,加入1.00mL 1.00×10-3mol/L碘水,正好将所取溶液中过量的硫代硫酸钠完全氧化.
(1)写出步骤①中CO通过盛I2O5加热管的有关反应化学方程式.
(2)计算样品中CO的浓度.
查看习题详情和答案>>
①首先将2.00L的气体样品通过盛有I2O5固体的加热管,反应后生成CO2和I2;
②用30.0mL 5.00×10-3mol/L的硫代硫酸钠溶液吸收所产生的碘,发生的反应为:I2+2S2O32-=2I-+S4O62-
③将②中溶液取出1/5,加入1.00mL 1.00×10-3mol/L碘水,正好将所取溶液中过量的硫代硫酸钠完全氧化.
(1)写出步骤①中CO通过盛I2O5加热管的有关反应化学方程式.
(2)计算样品中CO的浓度.
(2012?江苏)废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
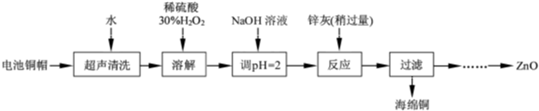
(1)①铜帽溶解时加入H2O2 的目的是
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为
②若滴定前溶液中的H2O2 没有除尽,所测定的Cu2+含量将会
(3)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0mol?L-1计算).
实验中可选用的试剂:30%H2O2、1.0mol?L-1HNO3、1.0mol?L-1NaOH.由除去铜的滤液制备ZnO 的实验步骤依次为:
①
查看习题详情和答案>>

(1)①铜帽溶解时加入H2O2 的目的是
Cu+H2O2+H2SO4=CuSO4+2H2O
Cu+H2O2+H2SO4=CuSO4+2H2O
(用化学方程式表示).②铜帽溶解完全后,需将溶液中过量的H2O2 除去.除去H2O2 的简便方法是加热至沸
加热至沸
.(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为
淀粉溶液
淀粉溶液
,滴定终点观察到的现象为蓝色褪去
蓝色褪去
.②若滴定前溶液中的H2O2 没有除尽,所测定的Cu2+含量将会
偏高
偏高
(填“偏高”、“偏低”或“不变”).(3)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0mol?L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
①
向滤液中加入30%H2O2,使其充分反应
向滤液中加入30%H2O2,使其充分反应
;②滴加1.0mol?L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全
滴加1.0mol?L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全
;③过滤;④向滤液中滴加1.0mol?L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全
向滤液中滴加1.0mol?L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全
;⑤过滤、洗涤、干燥;⑥900℃煅烧.