网址:http://m.1010jiajiao.com/timu3_id_367673[举报]
(10分)在实验室里可用如图所示装置制取氯酸钾和探究氯水的性质。图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置。请填写下列空白:
⑴制取氯气时,先在烧瓶里加入一定量的二氧化锰,再通过__________ ___(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_____________(填写下列编号字母)的净化装置。
___(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_____________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸
⑵如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因有:①_______________________________________________,
②__________________________________________________________________________。
⑶反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
⑷实验中可观察到③的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______________________________________ |
| 然后溶液从无色逐渐变为_______色 | ______________________________________ |
(10分)
某实验需要100 mL、0.1 mol/L的Na2CO3溶液,现通过如下操作配制:
①把称量好的固体Na2CO3放入小烧杯中,加适量蒸馏水溶解。为加快溶解可以使用 (填仪器名称)搅拌
②把①所得溶液冷却到室温后,小心转入 (填仪器名称)
③继续加蒸馏水至液面至刻度线1~2cm处,改用 (填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切
④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入容量瓶,并轻轻摇匀
⑤将容量瓶塞紧,充分摇匀。
(1)操作步骤正确的顺序是 (填序号)。
(2)若所配溶液的密度为1.06 g/mL,则该溶液的质量分数为 。
(3)若取出20 mL配好Na2CO3的溶液,加蒸馏水稀释成c(Na+) ="0.01" mol/L的溶液,则稀释后溶液的体积为 mL
(4)在配制100 mL、0.1 mol/L的Na2CO3溶液时,下列操作中的 会导致结果偏低(请用
序号填写)
a.将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
b.定容时俯视刻度线
c.定容时仰视刻度线
d.干净的容量瓶未经干燥就用于配制溶液
(06年江苏卷)(10分)苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛。

试回答下列问题:
⑴Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是______________。
⑵甲苯经氧化后得到的混合物通过结晶、过滤进行分离。该过程中需将混合物冷却,其目的是______________。
⑶实验过程中,可循环使用的物质分别为_______、_______。
⑷实验中分离甲苯和苯甲醛采用的操作Ⅰ是______________,其原理是______________。
⑸实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表)。
反应时间/h | 1 | 2 | 3 | 4 | 5 |
苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因______________。
查看习题详情和答案>>(06年江苏卷)(10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。

请按要求填空:
⑴反应③的化学方程式______________。
⑵C的结构式______________;H的化学式______________。
⑶L的溶液与化合物E反应的离子方程式______________。
⑷化合物J的化学式______________。
查看习题详情和答案>>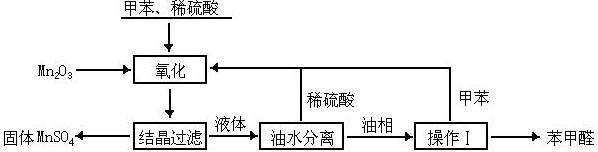
试回答下列问题:
⑴Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是______________。
⑵甲苯经氧化后得到的混合物通过结晶、过滤进行分离。该过程中需将混合物冷却,其目的是______________。
⑶实验过程中,可循环使用的物质分别为_______、_______。
⑷实验中分离甲苯和苯甲醛采用的操作Ⅰ是______________,其原理是______________。
⑸实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表)。
反应时间/h | 1 | 2 | 3 | 4 | 5 |
苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因______________。
查看习题详情和答案>>