网址:http://m.1010jiajiao.com/timu3_id_36713[举报]
水体污染物有:I含盐酸的酸性废水,II油类、氰化物、硫化物,III重金属离子;污水处理的化学方法有:a中和法,b氧化还原法,c沉淀法。所采用的方法对水体污染物处理不正确的是
A.I-a B.I-b C.II-b D.III-c
查看习题详情和答案>>
水体污染物有:I含盐酸的酸性废水,II油类、氰化物、硫化物,III重金属离子;污水处理的化学方法有:a中和法,b氧化还原法,c沉淀法。所采用的方法对水体污染物处理不正确的是
A.I→a B.I→b C.II→b D.III→c
查看习题详情和答案>>
I.从铝土矿中提取氧化铝的流程如下图所示:
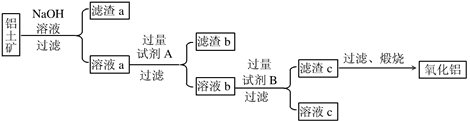
(2)向溶液a中通入过量的CO2,将得到的不溶物煅烧后也可得到Al2O3,该方案的缺点是____。
Ⅱ,电解熔融的氧化铝可制备金属铝
(3)电解时,阳极的电极反应方程式为____;每生产0. 324吨铝,理论上转移电子的物质的量为___mol。 ⅡI.新型陶瓷氮化铝可用以下两种方法制备:
(4)①氧化铝高温还原法:___Al2O3+___C+___N2
 ___AlN+___CO(请配平);
___AlN+___CO(请配平);②氯化铝与氨气高温合成法:AlCl3+NH3
 AlN+3HCl。
AlN+3HCl。 (5)方法②比方法①在生产上更具优势。下列说法中,正确的是______。
A.方法①中的Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
①__________________________________________________________。
②__________________________________________________________。
③__________________________________________________________。
(2)氢气是一种高效而无污染的理想能源。下列①—⑥是某化学兴趣小组的学生查阅资料归纳出的工业上制取氢气的方法,其中包括正在研究的方案。
①电解法:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
②甲烷转化法:CH4+H2O![]() CO+3H2
CO+3H2
③水煤气法:C+H2O![]() CO+H2
CO+H2
④碳氢化合物热裂解法:CH4![]() C+2H2
C+2H2
⑤设法将太阳光聚集产生高温使水分解:
2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
⑥寻找高效催化剂使水分解产生H2
如果将来人类广泛使用氢气作为能源,那么上述6种方法中你认为可行且很有发展前途的方法是哪几种?并逐条说明理由。
查看习题详情和答案>>水体污染物有:I含盐酸的酸性废水,II油类、氰化物、硫化物,III重金属离子;污水处理的化学方法有:a中和法,b氧化还原法,c沉淀法。所采用的方法对水体污染物处理不正确的是
| A.I-a | B.I-b | C.II-b | D.III-c |