摘要:4.氧化法:如MnO2+4HClMnCl2+Cl2↑+2H2O 4NaBr+3H2SO4+MnO2=2Na2SO4+MnSO4+2Br2+3H2O 2H2S+SO2=3S+2H2O
网址:http://m.1010jiajiao.com/timu3_id_36712[举报]
KClO3和KIO3在日常生活、工农业生产和科研方面有着广泛的应用.
(1)实验室可用KClO3分解制取O2,KClO3受热分解的反应分两步进行:①4KClO3(s)=3KClO4(s)+KCl(s);②KClO4(s)=KCl(s)+2O2(g).已知:
K(s)+
Cl2(g)=KCl(s)△H=-437kJ?mol-1
K(s)+
Cl2(g)+
O2(g)=KClO3(s)△H=-398kJ?mol-1
K(s)+
Cl2(g)+2O2(g)=KClO4(s)△H=-433kJ?mol-1
则反应4KClO3(s)=3KClO4(s)+KCl(s)的△H=
(2)Ca(IO3)2是食品及饲料添加剂补充碘源的优良品种.工业上生产Ca(IO3)2的方法通常有两类:
方法一:氧化剂氧化法.如:用KClO3在盐酸存在条件下,将碘单质氧化为HIO3(KClO3被还原为Cl2),然后加Ca(OH)2中和制得Ca(IO3)2.
方法二:电化学氧化法.用适宜浓度的KOH溶液溶解工业精碘作为阳极液(3I2+6KOH=5KI+KIO3+3H2O),用稀KOH溶液为阴极液,电解氧化制 备KIO3,与CaCl2反应得到Ca(IO3)2.
①用KClO3氧化碘单质是一剧烈的放热反应,所以要控制加料速度,与电解氧化法相比缺点主要有
②电化学氧化法电解时的阳极反应式是
③某工厂用电化学氧化法制取Ca(IO3)2,每1kg碘单质理论上可生产纯度为97.8%Ca(IO3)2的质量为
查看习题详情和答案>>
(1)实验室可用KClO3分解制取O2,KClO3受热分解的反应分两步进行:①4KClO3(s)=3KClO4(s)+KCl(s);②KClO4(s)=KCl(s)+2O2(g).已知:
K(s)+
| 1 |
| 2 |
K(s)+
| 1 |
| 2 |
| 3 |
| 2 |
K(s)+
| 1 |
| 2 |
则反应4KClO3(s)=3KClO4(s)+KCl(s)的△H=
-144kJ/mol
-144kJ/mol
kJ/mol.(2)Ca(IO3)2是食品及饲料添加剂补充碘源的优良品种.工业上生产Ca(IO3)2的方法通常有两类:
方法一:氧化剂氧化法.如:用KClO3在盐酸存在条件下,将碘单质氧化为HIO3(KClO3被还原为Cl2),然后加Ca(OH)2中和制得Ca(IO3)2.
方法二:电化学氧化法.用适宜浓度的KOH溶液溶解工业精碘作为阳极液(3I2+6KOH=5KI+KIO3+3H2O),用稀KOH溶液为阴极液,电解氧化制 备KIO3,与CaCl2反应得到Ca(IO3)2.
①用KClO3氧化碘单质是一剧烈的放热反应,所以要控制加料速度,与电解氧化法相比缺点主要有
反应剧烈,需要控制速率;反应过程中产生氯气,对生产操作环境有较大污染
反应剧烈,需要控制速率;反应过程中产生氯气,对生产操作环境有较大污染
.②电化学氧化法电解时的阳极反应式是
I-+6OH--6e-=IO3-+3H2O
I-+6OH--6e-=IO3-+3H2O
.③某工厂用电化学氧化法制取Ca(IO3)2,每1kg碘单质理论上可生产纯度为97.8%Ca(IO3)2的质量为
1.57kg
1.57kg
kg(计算结果保留叁位有效数字). Cl2是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.
Cl2是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.Ⅰ:如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
(1)写出A中发生的离子反应方程式:
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
(2)装置B中饱和食盐水的作用是
除去Cl2中的HCl
除去Cl2中的HCl
;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象锥形瓶中液面下降,长颈漏斗中液面上升
锥形瓶中液面下降,长颈漏斗中液面上升
.(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入
d
d
.| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
①该反应中的氧化剂是
Na2O2
Na2O2
,还原剂是Na2O2和FeSO4
Na2O2和FeSO4
,每生成1mol Na2FeO4转移5NA
5NA
个电子.②简要说明K2FeO4作为水处理剂时所起的作用
高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降
高铁酸钾具有强氧化性,能杀菌消毒;消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体能吸附水中悬浮杂质而沉降
,(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O.写出并配平湿法制高铁酸钾的离子反应方程式:
2Fe(OH)3+3C1O-+4OH-═2FeO42-+3C1-+5H2O
2Fe(OH)3+3C1O-+4OH-═2FeO42-+3C1-+5H2O
.I.某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如图1:
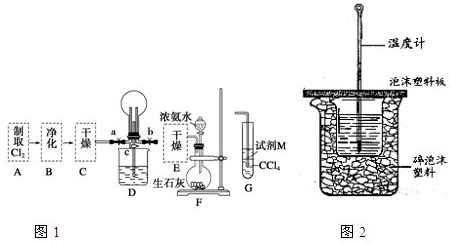
①利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管).请写出A中发生反应的离子方程式
②已知3Cl2+2NH3═6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为
II.用如图2所示装置进行中和热测定实验,请回答下列问题:
①从实验装置上看,图中缺少的一种玻璃仪器是
②使用补全仪器后的装置进行实验,取50mL 0.30mol/L H2SO4溶液与50mL 0.65mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高4.0℃.近似认为0.65mol/L NaOH溶液和0.30mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g?℃).通过计算可得中和热△H=
③实验中若用60mL0.30mol?L-1H2SO4溶液跟50mL0.65mol?L-1NaOH溶液进行反应,与上述实验相比,所求中和热
查看习题详情和答案>>

①利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管).请写出A中发生反应的离子方程式
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
,试剂M为
| ||
FeI2
FeI2
溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色
先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色
.②已知3Cl2+2NH3═6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为
黄绿色气体消失,产生白烟
黄绿色气体消失,产生白烟
,反应一段时间后,关闭b打开c,观察到的现象为烧杯中的液体进入烧瓶中,形成喷泉
烧杯中的液体进入烧瓶中,形成喷泉
.II.用如图2所示装置进行中和热测定实验,请回答下列问题:
①从实验装置上看,图中缺少的一种玻璃仪器是
环形玻璃搅拌棒
环形玻璃搅拌棒
.②使用补全仪器后的装置进行实验,取50mL 0.30mol/L H2SO4溶液与50mL 0.65mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高4.0℃.近似认为0.65mol/L NaOH溶液和0.30mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g?℃).通过计算可得中和热△H=
-55.7kJ?mol-1
-55.7kJ?mol-1
,③实验中若用60mL0.30mol?L-1H2SO4溶液跟50mL0.65mol?L-1NaOH溶液进行反应,与上述实验相比,所求中和热
相等
相等
(填“相等”、“不相等”);若用50mL0.60mol?L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会偏小
偏小
(填“偏大”、“偏小”、“不受影响”).(2012?上饶一模)已知A、B、D、E四种物质中均含有同一种短周期元素,该元素原子的最外层电子数是内层电子数的3倍,D为气体单质,E为黑色粉末.如图转化关系中E均起催化作用(某些产物已略去).则:

(1)A的化学式为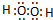
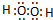 .
.
(2)已知E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X.甲同学为探究该气体的性质,设计了如图装置(Ⅲ中夹持装置已略去).

①写出Ⅰ中反应的离子方程式
②实验结束后,该同学在装置Ⅲ中观察到a、b试纸均褪色,而没有出现“a无明显现象”这一预期现象,为达到实验目的,他在
③Ⅳ中的溶液先变蓝色随后又褪色,甲同学猜想褪色的原因是又发生了如下氧化还原反应,请完成该反应(系数为“1”可以省略):
④装置Ⅴ的作用是
查看习题详情和答案>>

(1)A的化学式为
KClO3
KClO3
;B的电子式为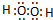
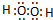
(2)已知E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X.甲同学为探究该气体的性质,设计了如图装置(Ⅲ中夹持装置已略去).

①写出Ⅰ中反应的离子方程式
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
②实验结束后,该同学在装置Ⅲ中观察到a、b试纸均褪色,而没有出现“a无明显现象”这一预期现象,为达到实验目的,他在
装置Ⅱ和Ⅲ
装置Ⅱ和Ⅲ
(填装置序号)之间又添加了一个装置,该装置的作用是除去氯气中的水蒸气(或:干燥氯气)
除去氯气中的水蒸气(或:干燥氯气)
.③Ⅳ中的溶液先变蓝色随后又褪色,甲同学猜想褪色的原因是又发生了如下氧化还原反应,请完成该反应(系数为“1”可以省略):
5Cl2
5Cl2
+1
1
I2+6H2O
6H2O
═10HCl
10HCl
+2
2
HIO3④装置Ⅴ的作用是
吸收尾气,防止Cl2污染环境
吸收尾气,防止Cl2污染环境
.某化学实验小组为了探究在实验室制备Cl2的过程中有 水蒸气和 HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置.按要求回答问题.
(1)如何检查装置A气密性?
(2)①装置B中盛放的试剂为
②装置D和E中出现的不同现象说明的问题是
③装置F的作用是
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在
查看习题详情和答案>>

(1)如何检查装置A气密性?
用止水夹夹住c处,向分液漏斗中加水,打开分液漏斗的活塞,若分液漏斗中的水不再下流,则证明A气密性良好
用止水夹夹住c处,向分液漏斗中加水,打开分液漏斗的活塞,若分液漏斗中的水不再下流,则证明A气密性良好
写出装置A中反应的离子方程式MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
(2)①装置B中盛放的试剂为
无水硫酸铜
无水硫酸铜
,装置C中的盛放的试剂为五氧化二磷
五氧化二磷
,装置C的作用是除水蒸气
除水蒸气
②装置D和E中出现的不同现象说明的问题是
氯气无漂白性,次氯酸有漂白性
氯气无漂白性,次氯酸有漂白性
.③装置F的作用是
吸收氯气
吸收氯气
.(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在
F
F
与G
G
之间(填装置字母序号),装置中应放入湿润的淀粉KI试纸
湿润的淀粉KI试纸
(填写试剂或用品名称)