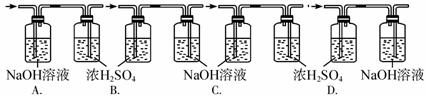
摘要:除去氯气中的少量氯化氢,应选用的试剂是 A.蒸馏水 B.KI的浓盐酸溶液 C.KI水溶液 D.饱和食盐水
网址:http://m.1010jiajiao.com/timu3_id_366623[举报]
氯化钠、氢氧化钠 、碳酸钠和碳酸氢钠是生活中常见的物质。
请回答下列问题。
(1)粗盐中含有可溶性CaCl2、MgCl2 Na2SO4杂质,除去这些杂质的试剂可选用
①Na2CO3、②NaOH、③BaCl2、④ HCl ,加入试剂的先后顺序可以是
(2)等质量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者 后者
(填 >、< 或 =)。
(3)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为
。
(4) 除去NaHCO3溶液中的少量Na2CO3,方法是:
离子方程式: 。
(5)钠与氢气在加热条件下能发生反应,生成一种白色固体。其中氢元素的化合价为-1价,写出白色固体与水剧烈反应生成氢气的化学方程式为
查看习题详情和答案>>制取纯净的氯化铜晶体(CuCl2?2H2O)的生产过程如下:
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2.
II.对I中所得到的溶液按下列步骤进行提纯.
已知:
试回答下列问题:
(1)下列物质中,最适合作为氧化剂X的是
A.KMnO4 B.K2Cr2O4 C.H2O2 D.NaClO
(2)①加入的物质Y是
(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2?2H2O),应采取的措施是
(4)①某同学利用反应:Cu+2H+═Cu2++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为
(5)已知一些难溶物的浓度积常数如下表:
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的
①NaOH ②FeS ③Na2S.
查看习题详情和答案>>
I.将粗氧化铜(含少量Fe)溶解在足量的稀盐酸中,然后加热、过滤得到CuCl2(含少量FeCl2)溶液,经测定,溶液pH为2.
II.对I中所得到的溶液按下列步骤进行提纯.

已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(1)下列物质中,最适合作为氧化剂X的是
C
C
.(填序号)A.KMnO4 B.K2Cr2O4 C.H2O2 D.NaClO
(2)①加入的物质Y是
CuO或Cu(OH)2或CuCO3
CuO或Cu(OH)2或CuCO3
.②写出沉淀Z在水中的沉淀溶解平衡方程式:Fe(OH)3(s) Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)
 Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)Fe(OH)3(s) Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)
. Fe2+(aq)+3OH-(aq)
Fe2+(aq)+3OH-(aq)(3)分离出沉淀Z,并将滤液蒸发,欲获得氯化铜晶体(CuCl2?2H2O),应采取的措施是
在HCl气流下加热浓缩,冷却结晶
在HCl气流下加热浓缩,冷却结晶
.(4)①某同学利用反应:Cu+2H+═Cu2++H2↑设计实验来制取CuCl2溶液,该同学设计的装置应该为
电解池
电解池
.(填“原电池”或“电解池”)②请你在下面方框中画出该同学设计的装置图,并指明电极材料和电解质溶液.(5)已知一些难溶物的浓度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
②
②
除去它们.(选填序号)①NaOH ②FeS ③Na2S.