摘要:1.将1molN2和3molH2反应.达到平衡时.混和气体中含92%的NH3.则H2体积百分含量为 A 2% B 3% C 4% D 6%
网址:http://m.1010jiajiao.com/timu3_id_365833[举报]
合成氨反应的热化学方程式为:N2(g)+3H2(g)
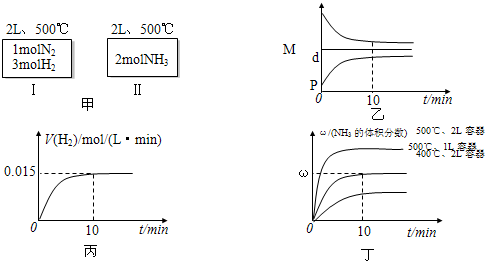
2NH3(g);△H=-92.4kJ/mol现将1molN2和3molH2加入到2L的固定密闭容器中,在500℃下进行反应,10min达到平衡,NH3的体积分数为ω.下列说法正确的是( )
查看习题详情和答案>>
| 高温、高压 |
| 催化剂 |

| A.如甲图所示:Ⅰ、Ⅱ两种途径中达到平衡时,NH3的体积分数均为ω,且Ⅰ中放出的热量与Ⅱ中吸收的热量之和为92.4kJ |
| B.反应进程中,混合气体的平均相对分子质量(M)、混合气体的密度(d)、混合气体的压强(P)三者的变化趋势如图乙所示 |
| C.若达到平衡时放出的热量为9.24kJ,则氢气的反应速度变化曲线如图丙所示 |
| D.若起始加入的物料均为1molN2、3molH2,在不同条件下达到平衡时,NH3的体积分数变化曲线如丁图所示 |
已知可逆反应:N2(g)+3H2(g)2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是( )
A.加压可使该反应的反应速率变大
B.升高温度,该反应的正、逆反应速率均变大
C.将1molN2和3molH2混合进行反应,反应完成时放出的热量为92kJ
D.单位时间内生成1molN2,同时消耗3molH2说明该反应达到平衡状态
查看习题详情和答案>>
已知可逆反应:N2(g)+3H2(g)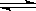 2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是
2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是
A.加压可使该反应的反应速率变大
B.该反应中反应物的总能量比生成物的总能量高
C.将1molN2和3molH2混合进行反应,反应完成时放出的热量为92kJ
D.单位时间内生成1molN2,同时消耗3molH2说明该反应达到平衡状态
查看习题详情和答案>>
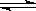 2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是
2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是
 2NH3(g)△H=-92kJ?mol-1下列关于此反应的说法中错误的是( )
2NH3(g)△H=-92kJ?mol-1下列关于此反应的说法中错误的是( )