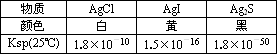摘要:17.在一定温度下.难溶电解质AmBn在水中可建立如下平衡:AmBn(s)mAn++nBm-.在一定温度下.当达到溶解平衡时.c(An+)m·c(Bm-)n为一个常数.用Ksp表示.在一定温度下.当c(An+)m·c(Bm-)n =Ksp时溶液达到饱和.沉淀量既不增加也不减少,当c(An+)m·c(Bm-)n >Ksp时.将析出沉淀,当c(An+)m·c(Bm-)n<Ksp时.沉淀将溶解.根据上述原理计算: (1)已知在常温下.FeS的Ksp=6.25×10-18.计算该温度下FeS的溶解度.(设溶液的密度为1.0 g/mL) (2)又知H2S的饱和溶液中存在着以下关系: c(H+)2· c(S2-)=1.0×10-22.在该温度下.将适量FeS投入H2S饱和溶液中.欲使溶液中c(Fe2+)达到1.0 mol/L.应调节溶液的pH为多少?
网址:http://m.1010jiajiao.com/timu3_id_365542[举报]
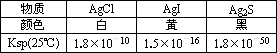
(一定温度下,难溶电解质AmBn在水中溶解平衡的溶度积为Ksp=cm(An+)×cn(Bm-)。25℃,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,先出现黄色沉淀,最终生成黑色沉淀。已知有关物质的颜色和溶度积如下:
| 物质 | AgCl | AgI | Ag2S |
| 颜色 | 白 | 黄 | 黑 |
| Ksp(25℃) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
下列叙述不正确的是
- A.溶度积小的沉淀可以转化为溶度积更小的沉淀
- B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
- C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
- D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
一定温度下,难溶电解质Ambn在水中溶解平衡的溶度积为Ksp =cm(An+)×c(Bn-)。25℃,向AgCl的白色 悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,先出现黄色沉淀,最终生成黑色沉淀。已知有关物质的颜色和溶度积如下:

下列叙述错误的是
[ ]
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中溶度积相同
查看习题详情和答案>>
B.若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中溶度积相同
|
一定温度下 ,难溶电解质AmBn在水中溶解平衡的溶度积为Ksp=cm(An+)×cn(Bm-),25℃,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,先出现黄色沉淀,最终生成黑色沉淀.已知有关物质的颜色和溶度积如下:
下列叙述不正确的是 | |
A. |
溶度积小的沉淀可以转化为溶度积更小的沉淀 |
B. |
若先加入 Na2S溶液,再加入KI溶液,则无黄色沉淀产生 |
C. |
25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 |
D. |
25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 |
|
一定温度下,难溶电解质AmBn在水中溶解平衡的溶度积为Ksp=cm(An+)×cn(Bm-).25℃,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,先出现黄色沉淀,最终生成黑色沉淀.已知有关物质的颜色和溶度积如下:
下列叙述不正确的是 | |
A. |
溶度积小的沉淀可以转化为溶度积更小的沉淀 |
B. |
若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生 |
C. |
25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 |
D. |
25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同 |
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时.已知下表数据物质对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
|
查看习题详情和答案>>