网址:http://m.1010jiajiao.com/timu3_id_365465[举报]
环境保护是我国的一项基本国策。含CN-的污水毒性和危害极大。治理含CN-污水的方法之一是:在催化剂TiO2作用下,用NaClO将CN-氧化成CNO-,CNO-在酸性条件下继续被NaClO氧化成CO2、N2和H2O。其离子反应方程式为:2CN-+5ClO-+2H+===2CO2↑+N2↑+5Cl-+H2O,试根据要求回答下列问题:
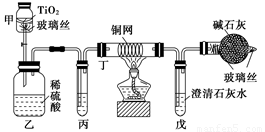
(1)将浓缩后含CN-的污水(其中CN-浓度为0.05 mol/L)200 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡皮塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。
①乙装置中生成的气体除含有CO2、N2、HCl外还有副反应生成的Cl2等,写出生成Cl2的副反应的离子方程式: _______________________________________。
②丙中加入的除杂试剂是________(填字母代号)。
A.饱和食盐水 B.饱和碳酸氢钠溶液
C.浓NaOH溶液 D.浓硫酸
③丁在实验中的作用是_______________________________________________________。
④戊中盛有足量石灰水,若实验后戊中共生成0.8 g沉淀,则该实验中CN-被处理的百分率________(填“>”、“=”或“<”)80%。(不考虑CO2的溶解)
(2)上述实验中造成戊中碳酸钙质量测定值偏小的可能原因有(写出两点即可):________________________________________________________________________。
查看习题详情和答案>>