网址:http://m.1010jiajiao.com/timu3_id_365010[举报]

Ⅰ.(1)已知A是
 的单体.则A中所含官能团的名称是
的单体.则A中所含官能团的名称是(2)写出B的结构简式并用系统命名法给C命名:
B:
(3)L是E的向分异构体,L分子中含有苯环且苯环上一氯代物只有两种,则L所有可能的结构简式有
 、
、





(4)F→G的反应类型是
(5)下列关于室安卡因(G)的说法正确的是
a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.能与盐酸反应生成盐 d.属于氨基酸
(6)写出C与足量NaOH醇溶液共热时反应的化学方程式:


Ⅱ.H是C的同系物,其核磁共振氢谱有两个峰.按如下路线,由H可合成高聚物V:

(7)H的结构简式为


(8)写出Q→V的反应方程式:


 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.A.[物质结构]
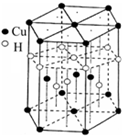
[Cu(NH3)4]SO4?H2O是一种杀虫剂.
(1)Cu元素基态原子的电子排布式为
(2)元素N、O、S的第一电离能由大到小排列的顺序为
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为
(5)与S
| O | 2- 4 |
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为
B.[实验化学]
目前市场上大量矿泉水、食用油等产品包装瓶几乎都是用PET(聚对苯二甲酸乙二醇酯,简称聚酯)制作的.利用废聚酯饮料瓶制备对苯二甲酸的反应原理如下:
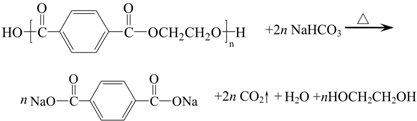
实验过程如下:
步骤1:在100mL四颈瓶上分别装置冷凝管、搅拌器和温度计.依次加入5g废饮料瓶碎片、0.05g氧化锌、5g碳酸氢钠和25mL乙二醇.缓慢搅拌,油浴加热,升温至180℃,反应15分钟.
步骤2:冷却至160℃停止搅拌,将搅拌回流装置改成搅拌、减压蒸馏装置,减压蒸馏.
步骤3:向四颈瓶中加入50mL沸水,搅拌使残留物溶解.抽滤除去少量不溶物.
步骤4:将滤液转移到400mL烧杯中,用25mL水荡洗滤瓶并倒入烧杯中,再添加水使溶液总体积达200mL,加入沸石,将烧杯置于石棉网上加热煮沸.
步骤5:取下烧杯,取出沸石后趁热边搅拌边用8~10mL 1:1HCl酸化,酸化结束,体系呈白色浆糊状.
步骤6:冷至室温后再用冰水冷却.抽滤,滤饼用蒸馏水洗涤数次至滤出液pH=6,抽干后再用10mL丙酮分2次洗涤,抽干,干燥.
(1)步骤1反应过程中的现象是
(2)步骤2是为了分离出
(3)步骤3抽滤需要用到的主要仪器有
(4)步骤4加沸石的目的是
(5)步骤5用盐酸酸化的目的是
(6)步骤6用丙酮洗涤的目的是
过氧化尿素是一种无毒无味的白色粉末,是一种新型的漂白剂与消毒剂。它的合成方式如下:
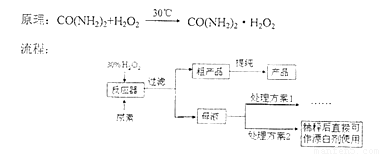
请回答下列问题:
(1)根据反应原理,CO(NH2)2·H2O2分子内存在的作用力
是 。
A.共价键 B.离子键
C.金属键 D.氢键
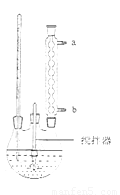
(2)流程图中反应器的装置如图所示,推测该反应的加热方式是 ;回流管中冷水流从 口流入;搅拌器选用的材质是玻璃而不是铁质或铝质材料的原因是 。
(3)母液处理方案1可以是 (用文字表达)。若欲从母液中离出H2O2和尿素,可采用的操作是 (选填序号)
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(4)为测定产品中活性氧的含量(活性氧16%,相当于H2O234%),称取干燥样品2.000g,溶解,在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL 6mol·L-1的硫酸,然后用0.1000mol·L-1 KMnO4标准溶液滴定,至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液8.00mL(KMnO4溶液与尿素不反应)。
①完成并配平方程式: MnO4-+ H2O2+ H+= MnO2++ H2O+
②若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 。(“偏高”、“偏低”或“不变”)。
③根据滴定结果,可确定产品中活性氧的质量分数为 。
查看习题详情和答案>>
(15分)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
⑴常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是 .
⑵A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 .
⑶A、B、D、E四种元素组成的某无机化合物浓度为0.1 mol/L时,pH最接近 .
A.5.6 B.7.0 C.8.4 D.13.0
⑷在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g) 2CA3(g)
2CA3(g)
ΔH=-92.4 kJ·mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,总容积为1.0 L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol,A2 0.5mol,CA3 0mol
B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L,CA3 0.2mol/L
②求算此平衡体系的平衡常数K=________;
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将________(填“正向”、“逆向”或“不”)移动.理由是
.
④已知0.4mol 液态C2 A4与足量的液态双氧水反应,生成C2和水蒸气,放出256.65 kJ
的热量.写出该反应的热化学方程式 .
查看习题详情和答案>>
(本题共8分)
白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸。根据题意回答:
1.31g白磷与足量的氧气完全燃烧生成P2O5固体,释放出745.5 kJ的热量,请写出白磷燃烧的热化学反应方程式: ;
2.完成并配平白磷和氯酸溶液反应的化学方程式:
P4 + HClO3 + → HCl + H3PO4
3.白磷有毒,在实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O → 20Cu3P + 24H3PO4 + 60H2SO4
该反应的氧化产物是 ,若有1.1 mol P4反应,则有 mol电子转移。
4.磷的一种化合物叫亚磷酸(H3PO3)。已知:⑴0.1 mol/L H3PO3溶液的pH = 1.7;⑵H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;⑶H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。关于H3PO3的说法:①强酸;②弱酸;③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是 .
| A.②④⑥ | B.②③⑥ | C.①④⑤ | D.②③⑤ |