摘要:2.用价层电子对互斥模型预测SO2Cl2.ICl4-的立体结构.并给出中心原子的氧化数和杂化轨道类型. 粒子 立体结构 中心原子 氧化数 中心原子 杂化轨道类型 SO2Cl2 ICl4-
网址:http://m.1010jiajiao.com/timu3_id_364520[举报]
 【化学一选修3物质结构与性质】
【化学一选修3物质结构与性质】已知A、B、C、D、E、F均为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子.D元素原子核外的M层中只有2对成对电子.B离子与E离子具有相同的电子层结构,可形成E2B2、E2B型化合物.F元素位于元素周期表的ds区,其原子与E原子具有相同的最外层电子数.
请回答下面的问题:
(1)根据以上信息推断:①B元素为
②F原子核外的价电子排布为
(2)指出在元素周期表中:①D元素在
(3)当n=2时,A与氢元素形成的相对分子质量为26的分子应属于
(4)当n=3时,A与B形成的晶体属于
(5)DCl2分子中,中心原子D有
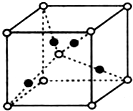
(6)元素F的某种氧化物的晶体晶胞结构如右上图所示,其中实心球表示F原子,则该氧化物的化学式为
(7)A-F六种元素中,有一种元素的部分电离能数据如下,它可能是
| 电离能 | I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| (KJ.mol-1) | 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
已知A,B,C,D,E,F均为前四周期元素,A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍.C元素原子的M电子层的P亚层中有3个未成对电子.D元素原子核外的M层中只有两对成对电子,B离子与E离子具有相同的电子层结构.可形成E2B2,E2B型化合物.F元素位于元素周期表的ds区.其原子与E原子具有相同的最外层电子数.
请回答下面的问题:
(1)根据以上信息推断:①B元素为
(2)当n=2时.A与氢元素形成的相对分子质量为26的分子应属于
(3)DCl2分子中,中心原子D有
查看习题详情和答案>>
请回答下面的问题:
(1)根据以上信息推断:①B元素为
O
O
(2)当n=2时.A与氢元素形成的相对分子质量为26的分子应属于
非金属
非金属
分子(填记性或非极性),该分子中有3
3
个σ键和2
2
个π键(3)DCl2分子中,中心原子D有
2
2
对孤对电子,用价层电子对互斥模型推测:DCl2分子的空间构型为V
V
型. Cl2 ;SO32-
Cl2 ;SO32-