网址:http://m.1010jiajiao.com/timu3_id_363820[举报]
在容积相同的不同密闭容器中内,分别充入同量的N2和H2,在不同温度下,任其发生反应:3H2
+ N2 2NH3,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。
2NH3,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。

(1)A、B、C、D、E五点中,尚未达到化学平衡状态的点是_____________。
(2)此可逆反应的正反应是____热反应。
(3)AC段曲线是增函数,CE段曲线是减函数,试从化学反应速率和化学平衡角度说明理由。
查看习题详情和答案>>
 ,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。
,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。
(2)此可逆反应的正反应是____热反应。
(3)AC段曲线是增函数,CE段曲线是减函数,试从化学反应速率和化学平衡角度说明理由。 _____________________________________
在容积相同的不同密闭容器中内,分别充入同量的N2和H2,在不同温度下,任其发生反应:3H2 + N2 ![]() 2NH3,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。
2NH3,并分别在t0秒时测定其中NH3的体积分数[x(NH3)],绘成如图的曲线。

(1)A、B、C、D、E五点中,尚未达到化学平衡状态的点是_____________。
(2)此可逆反应的正反应是____热反应。
(3)AC段曲线是增函数,CE段曲线是减函数,试从化学反应速率和化学平衡角度说明理由。
查看习题详情和答案>>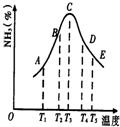 在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图:
在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图:(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是
(2)向一恒容容器中加入1mol N2和3mol H2,T3时,测得体系压强为原来的
| 7 | 8 |
(3)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3
产率的有
A 升高温度 B 降低温度 C 增大压强 D 减小压强
E 加入催化剂 F 吸收NH3 G 通入N2
(4)AC段的曲线和CE段曲线变化趋势相反,试从反应速率和平衡角度说明理由.
在容积不同的多个密闭容器内,分别充入同量的N2和H2,在不同温度下,同时发生反应N2+3H2![]() 2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如右:
(1)A,B,C,D,E五点中,尚未达到化学平衡状态的点是 。
(2) 向一恒容容器中加入1 mol N2 和3 mol H2,T3时,测得体系
压强为原来的7/8,并放出23.1 kJ的热量,则该反应的热化学方程式
为 。
(3)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3
产率的有 (填字母)
A 升高温度 B 降低温度 C 增大压强 D 减小压强
E 加入催化剂 F 吸收NH3 G 通入N2
(4)AC段的曲线和CE段曲线变化趋势相反,试从反应速率和平衡角度说明理由。
。
