摘要:11.用2mol/L的NaOH溶液滴定pH=5的HCN溶液100mL至中性.此时溶液中各离子浓度关系正确的是 A. c(Na+)>c(CN-)>c(OH-)>c(H+) B.c(CN-)>c(Na+)>c(H+)> c(OH-) C. c(Na+)+c(CN-)=2mol/L D.c(Na+)+c(OH-)= c(CN-)+c(H+)
网址:http://m.1010jiajiao.com/timu3_id_363562[举报]
乙二酸(HOOC-COOH)俗名草酸,易溶于水,属于二元中强酸,生产和科学实验中有着广泛的用途.草酸晶体的组成可用H2C2O4?xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100.00mL水溶液,量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol?L-1的KMnO4溶液滴定,
(1)将所发生的反应方程式完成并配平,将完整的化学方程式写在答题卡上.
KMnO4+H2C2O4+
(2)整个实验过程中不需要的仪器有
a.托盘天平(带砝码,镊子)b.酸式滴定管 c.烧瓶 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶
h.玻璃棒 i.药匙
(3)实验中,标准KMnO4溶液应盛装在
(4)在滴定过程中若用去amol?L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为
-5
-5.(用含W、a、V的代数式表示)
(5)该小组同学将0.02mol草酸晶体(H2C2O4?2H2O)加入到100mL0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为
查看习题详情和答案>>
(1)将所发生的反应方程式完成并配平,将完整的化学方程式写在答题卡上.
KMnO4+H2C2O4+
3H2SO4
3H2SO4
═K2SO4+CO2↑+MnSO4+8H2O
8H2O
(2)整个实验过程中不需要的仪器有
c,f
c,f
(填序号).a.托盘天平(带砝码,镊子)b.酸式滴定管 c.烧瓶 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶
h.玻璃棒 i.药匙
(3)实验中,标准KMnO4溶液应盛装在
酸
酸
式滴定管中.滴定终点时溶液的颜色变化为酸溶液由无色变为浅紫色且半分钟不褪色
酸溶液由无色变为浅紫色且半分钟不褪色
.(4)在滴定过程中若用去amol?L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为
0.1aV
0.1aV
mol?L-1,由此可计算x的值是| 50w |
| 9av |
| 50w |
| 9av |
(5)该小组同学将0.02mol草酸晶体(H2C2O4?2H2O)加入到100mL0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为
C(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
C(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
.NaHSO4与NaHCO3是两种重要的酸式盐.
(1)NaHSO4固体溶于水显酸性,而NaHCO3固体溶于水显碱性,请用离子方程式并配以必要的文字说明表示NaHCO3固体溶于水显碱性的原因
(2)常温下把l mL 0.2mol/L的NaHSO4溶液加水稀释成2L溶液,此时溶液中由水电离产生的c(H+)为
(3)NaHSO4和NaHCO3两溶液混合反应的离子方程式为
(4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至呈中性,请写出发生的离子方程式
(5)若将等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,反应的离子方程式为
查看习题详情和答案>>
(1)NaHSO4固体溶于水显酸性,而NaHCO3固体溶于水显碱性,请用离子方程式并配以必要的文字说明表示NaHCO3固体溶于水显碱性的原因
NaHCO3=Na++HCO3-、HCO3-+H2O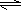 H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性
H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性
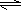 H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性
H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性NaHCO3=Na++HCO3-、HCO3-+H2O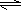 H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性
H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性
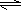 H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性
H2CO3+OH-且HCO3-水解程度大于电离程度,故溶液呈碱性(2)常温下把l mL 0.2mol/L的NaHSO4溶液加水稀释成2L溶液,此时溶液中由水电离产生的c(H+)为
1×10-10mol/L
1×10-10mol/L
.(3)NaHSO4和NaHCO3两溶液混合反应的离子方程式为
H++HCO3-=H2O+CO2↑
H++HCO3-=H2O+CO2↑
.(4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至呈中性,请写出发生的离子方程式
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
;在以上溶液中,继续滴加Ba(OH)2溶液,此时发生的离子方程式为SO42-+Ba2+=BaSO4↓
SO42-+Ba2+=BaSO4↓
.(5)若将等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,反应的离子方程式为
HCO3-+Ba2++OH-=BaCO3↓+H2O
HCO3-+Ba2++OH-=BaCO3↓+H2O
.