摘要:9.下图所示反应有直接进行的.也有在溶液中进行的.其中部分产物已略去.已知:A是固体单质,B.X.H为气体单质,D属于可溶于水的强电解质.一个D分子中含有18个电子. (1)化学式:B为 .F为 ; (2)写出D的电子式 ,液态D能否导电 , (3)A是一种非常重要的工业产品.据统计.地球上每年由于腐蚀而消耗的A约占A年产量的10%.A发生腐蚀的主要原因是 , a.直接与氧气发生化学腐蚀 b.通过原电池反应发生腐蚀 c.因溶于水而消耗掉 若你选定选项a或c.请写出相应的化学方程式,若你选定选项b.请写出负极的电极反应式: , (4)已知H的密度约是空气密度的1.1倍.则①中所涉及的反应的化学方程式为: , . H2 FeCl2 (2) 否 (3)b Fe-2e-=Fe2+ (4)2Na2O2+2H2O=4NaOH+O2↑ FeCl3+3NaOH=Fe(OH)3↓+3NaCl
网址:http://m.1010jiajiao.com/timu3_id_363317[举报]
(2010?潍坊一模)选做[有机化学基础]
以HCHO和CH≡CH为有机原料,经过下列反应可得化合物N(C4H8O2).

A与M互为同分异构体,A能发生如下转化:

填写下列空白:
(1)反应I的反应类型为
(2)N的同分异构体中,属于酯类的有
(3)A的结构简式为
 ,B中的官能团名称是
,B中的官能团名称是
(4)写出B与银氨溶液反应的化学方程式(有机物用结构简式表示):
 .
.
查看习题详情和答案>>
以HCHO和CH≡CH为有机原料,经过下列反应可得化合物N(C4H8O2).

A与M互为同分异构体,A能发生如下转化:

填写下列空白:
(1)反应I的反应类型为
加成反应
加成反应
.(2)N的同分异构体中,属于酯类的有
4
4
种.(3)A的结构简式为


醛基和醇羟基
醛基和醇羟基
.D化学式为C8H12O4
C8H12O4
.(4)写出B与银氨溶液反应的化学方程式(有机物用结构简式表示):


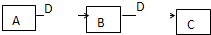 (2009?潍坊一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素.在一定条件下相互转化关系如下图所示(部分产物已略去).请按要求回答下列问题:
(2009?潍坊一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素.在一定条件下相互转化关系如下图所示(部分产物已略去).请按要求回答下列问题:(1)若B、C 为氧化物,B转化为C时,质量增加25%,则B转化为C的化学方程式是
2SO2+O2
2SO3
| 催化剂 |
| 加热 |
2SO2+O2
2SO3
.| 催化剂 |
| 加热 |
(2)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式是
FeCl3
FeCl3
;将B的溶液加热蒸干再灼烧,得到的固体物质的化学式是Fe2O3
Fe2O3
.(3)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是
Al3++3[Al(OH)4]-=4Al(OH)3↓
Al3++3[Al(OH)4]-=4Al(OH)3↓
;符合条件的D物质可能是①③
①③
(填序号)①硫酸 ②醋酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡.
 (2010?潍坊一模)铁元素及其化合物与人类的生产生活息息相关,
(2010?潍坊一模)铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%,的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出该反应的离子方程式
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
.(2)高炉炼铁过程中会发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g).
已知:Fe(s)+
| 1 | 2 |
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-22lkJ?mol-1
则:①FeO(s)+CO(g)?Fe(s)+CO2(g)△H=
一1lkJ?mol-1
一1lkJ?mol-1
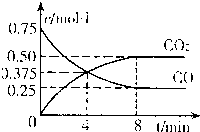
.②一定温度下,向某密闭容器中加入足量FeO,并充入一定量的CO气体,反应过程中CO和CO2的浓度与时间的关系如图所示
则从开始至达到平衡过程中,v(CO)=
0.625mol?L-1?min-1
0.625mol?L-1?min-1
;该温度下,FeO(s)+CO(g)?Fe(s)+CO2(g)的化学平衡常数K=2
2
.(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol?L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为
11.2g
11.2g
.(2009?潍坊一模)(1)玻璃棒是中学化学实验中常用的仪器.下列实验过程中,一般不需要用玻璃棒的是
①用pH试纸测定Na2CO3溶液的 pH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2?8H2O 晶体的NH4Cl 晶体反应过程中的能量变化
⑤实验室用新制的FeSO4 溶液和预处理过的NaOH 溶液制备Fe(OH)2 白色沉淀
(2)用“大于”、“小于”、或“等于”填空:
①读取量筒中液体体积时,视线偏高,读取的体积数
②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量
③配制500mL0.1mol?L-1NaOH 溶液,定容时俯视刻度线,所得溶液的物质的量浓度
④用中和滴定测某NaOH 溶液的浓度,量取待测液时末用该溶液润洗滴定管,测得的溶液浓度
查看习题详情和答案>>
③⑤
③⑤
(填写编号)①用pH试纸测定Na2CO3溶液的 pH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2?8H2O 晶体的NH4Cl 晶体反应过程中的能量变化
⑤实验室用新制的FeSO4 溶液和预处理过的NaOH 溶液制备Fe(OH)2 白色沉淀
(2)用“大于”、“小于”、或“等于”填空:
①读取量筒中液体体积时,视线偏高,读取的体积数
大于
大于
实际体积数②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量
小于
小于
10.4g.③配制500mL0.1mol?L-1NaOH 溶液,定容时俯视刻度线,所得溶液的物质的量浓度
大于
大于
0.1mol?L-1④用中和滴定测某NaOH 溶液的浓度,量取待测液时末用该溶液润洗滴定管,测得的溶液浓度
小于
小于
实际浓度.