网址:http://m.1010jiajiao.com/timu3_id_36325[举报]
(A)【物质结构与性质】
有A、B、C、D、E、F六种元素,B原子得到一个电子后3p轨道全充满,A+比B原子形成的离子少一个电子层;C原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的;D和E是位于同一主族的短周期元素,E元素的最高化合价和最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%;F元素的核电荷数为26。
请回答下列问题:
(1)A元素位于元素周期表中第_________周期第_________族;F元素基态原子形成的+2价阳离子的电子排布式为_________。
(2)C与B形成的CB3分子中C原子的杂化方式是_______,其分子的空间形状是_______。
(3)另一元素X与A同主族,其第一电离能小于A,晶体XB与AB熔点较高的是_________,其理由是_______________________________________________________________。
(4)1 mol ED晶体中含有的E—D共价键的数目是_________。
(B)【实验化学】
阿司匹林(乙酰水杨酸)是由水杨酸和乙酸酐合成的:
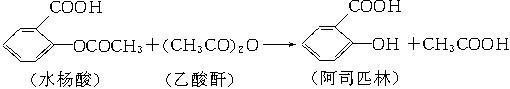
在生成乙酰水杨酸的同时,水杨酸分子之间也能发生聚合反应,生成少量聚合物(副产物)。合成乙酰水杨酸的实验步骤如下:
①向150 mL干燥锥形瓶中加入
②减压过滤,用滤液淋洗锥形瓶,直至所有晶体收集到布氏漏斗中。抽滤时用少量冷水洗涤晶体几次,继续抽滤,尽量将溶剂抽干。然后将粗产品转移至表面皿上,在空气中风干。
③将粗产品置于100 mL烧杯中,搅拌并缓慢加入25 mL 饱和碳酸氢钠溶液,加完后继续搅拌2—3 min,直到没有二氧化碳气体产生为止。过滤,用5—10 mL蒸馏水洗涤沉淀。合并滤液于烧杯中,不断搅拌,慢慢加入15 mL 4 mol·L-1盐酸,将烧杯置于冰水中冷却,即有晶体析出。抽滤,用冷水洗涤晶体1—2次,再抽干水分,即得产品。
请回答下列问题:
(1)第①步中,要控制温度在85—
(2)在第②步中,用冷水洗涤晶体,其目的是_________________________________________、__________________________________________。
(3)在第③步中,加入饱和碳酸氢钠溶液的作用是___________________________________,加入盐酸的作用是________________________________________。
(4)如何检验产品中是否混有水杨酸?___________________________________________
____________________________________________________________________。
查看习题详情和答案>>| A.二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| B.常温下浓硫酸能使铝发生钝化,可在常温下用铝制罐贮运浓硫酸 |
| C.碳酸氢钠受热易分解,可用加热的方法除去碳酸氢钠中混有的碳酸钠 |
| D.常温下,Kkp(Agl)>Kkp(AgCl),可在Agl、AgCl中混合悬浊液中加入浓KI溶液等操作除去AgCl. |
A.二氧化硅不与任何酸反应,可用石英制造耐酸容器
B.常温下浓硫酸能使铝发生钝化,可在常温下用铝制罐贮运浓硫酸
C.碳酸氢钠受热易分解,可用加热的方法除去碳酸氢钠中混有的碳酸钠
D.常温下,Kkp(Agl)>Kkp(AgCl),可在Agl、AgCl中混合悬浊液中加入浓KI溶液等操作除去AgCl.
查看习题详情和答案>>
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应的答题区域内作答.若两题都做,则按A题评分.A.[物质结构]
[Cu(NH3)4]SO4?H2O是一种杀虫剂.
(1)Cu元素基态原子的电子排布式为
(2)元素N、O、S的第一电离能由大到小排列的顺序为
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为
(5)与S
| O | 2- 4 |
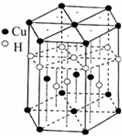
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为
B.[实验化学]
目前市场上大量矿泉水、食用油等产品包装瓶几乎都是用PET(聚对苯二甲酸乙二醇酯,简称聚酯)制作的.利用废聚酯饮料瓶制备对苯二甲酸的反应原理如下:
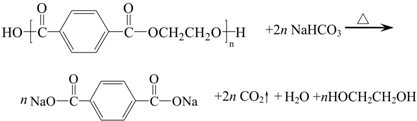
实验过程如下:
步骤1:在100mL四颈瓶上分别装置冷凝管、搅拌器和温度计.依次加入5g废饮料瓶碎片、0.05g氧化锌、5g碳酸氢钠和25mL乙二醇.缓慢搅拌,油浴加热,升温至180℃,反应15分钟.
步骤2:冷却至160℃停止搅拌,将搅拌回流装置改成搅拌、减压蒸馏装置,减压蒸馏.
步骤3:向四颈瓶中加入50mL沸水,搅拌使残留物溶解.抽滤除去少量不溶物.
步骤4:将滤液转移到400mL烧杯中,用25mL水荡洗滤瓶并倒入烧杯中,再添加水使溶液总体积达200mL,加入沸石,将烧杯置于石棉网上加热煮沸.
步骤5:取下烧杯,取出沸石后趁热边搅拌边用8~10mL 1:1HCl酸化,酸化结束,体系呈白色浆糊状.
步骤6:冷至室温后再用冰水冷却.抽滤,滤饼用蒸馏水洗涤数次至滤出液pH=6,抽干后再用10mL丙酮分2次洗涤,抽干,干燥.
(1)步骤1反应过程中的现象是
(2)步骤2是为了分离出
(3)步骤3抽滤需要用到的主要仪器有
(4)步骤4加沸石的目的是
(5)步骤5用盐酸酸化的目的是
(6)步骤6用丙酮洗涤的目的是