摘要:13.A.B.C.D是同一周期的四种元素.A.B.C的原子序数依次相差1.A 元素的单质的化学性质活泼.A元素的原子在本周期中原子半径最大.B元素的氧化物2.0 g恰好跟100 mL 0.40 mol/L 硫酸完全反应.B元素单质跟D元素单质反应生成化合物BD2. 根据以上事实填写下列空白: A的原子结构示意图 ,C离子的结构示意图 ,BD2的电子式 .若向C的氧化物的水化物中加入A的氧化物的水化物.则溶液呈碱性. 这一反应的化学方程式为 .B的单质能在原子序数为7的元素的单质中燃烧.这一反应的化学方程式为 .
网址:http://m.1010jiajiao.com/timu3_id_362646[举报]
有四种元素A、B、C、D位于元素周期表的前四周期,已知它们的核电荷数依次增大,且核电荷数之和为50;A为构成化合物种类最多的一种元素;B原子的L层p轨道中有2个电子;C与B原子的价层电子数相同;D原子的K层电子数与最外层电子数之比为2∶1. 请回答下列问题。
(1)写出D2+价层电子排布图__________________,其最外层有_________个单电子;
(2) B的最高价氧化物和C的最高价氧化物的晶体类型分别是_________晶体、_________ 晶体。
(3) CA4分子中C原子的杂化轨道类型是____________;
(4) A的氧化物与B的氧化物中,分子极性较小的是___________。(填化学式)
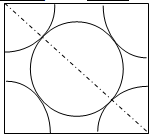
(5)已知单质D为面心立方晶体,如图所示,D的相对原子质量为M,密度为8.0 g/cm3,试求(提示:数出面心立方中的D的个数)
①图中正方形边长 a,(只要求列算NA表示阿伏伽德罗常数)
②试计算这类晶体中原子的空间利用率。 (过程及结果)
(1)写出D2+价层电子排布图__________________,其最外层有_________个单电子;
(2) B的最高价氧化物和C的最高价氧化物的晶体类型分别是_________晶体、_________ 晶体。
(3) CA4分子中C原子的杂化轨道类型是____________;
(4) A的氧化物与B的氧化物中,分子极性较小的是___________。(填化学式)
(5)已知单质D为面心立方晶体,如图所示,D的相对原子质量为M,密度为8.0 g/cm3,试求(提示:数出面心立方中的D的个数)
①图中正方形边长 a,(只要求列算NA表示阿伏伽德罗常数)
②试计算这类晶体中原子的空间利用率。 (过程及结果)
(10分)A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素。其中A中含有5个原子核,它们之间有如下的反应关系:

(1)A、D的电子式分别为:A  ,D
,D 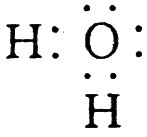 。
。
(2)B、C、D三种微粒结合质子能力x>y>z,(x、y、z分别代表B、C、D中的某一种微粒),则x、y、z分别代表的微粒符号为x OH- ,y NH3 ,z H2O 。
【解析】 A中含5个原子核,又由C+H+→A,推知A为NH![]() ,知C为NH3,B为OH-,D为H2O。
,知C为NH3,B为OH-,D为H2O。
A、B、C、D四种元素在周期表中分别处于元素X的四周如图

已知 X 元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的。
试确定:
⑴写出各元素的符号:A ,B ,C ,D ,X 。
⑵写出C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序: 。
⑶写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:
。
查看习题详情和答案>>
A、B、C、D是同一周期的四种元素。A、B、C的原子序数依次相差1,A元素的单质化学性质活泼,A元素的原子在同周期中原子半径最大。B元素的氧化物2.0 g 恰好跟100 mL 0.5 mol·L-1H2SO4完全反应,B元素单质跟D元素单质反应生成化合物BD2。根据以上事实填写下列空白:
(1)A的原子结构示意图为________________。
(2)C的原子结构示意图为________________。
(3)BD2的电子式为________________。
(4)若向C的氧化物的水化物中加入A的氧化物的水化物,则溶液显碱性。这一反应的化学程式为________________________________________________。
查看习题详情和答案>>