摘要: Mg,N,Br,Mg+Br2=MgBr2,Br2+H2O=HBr+HBrO,Mg+2HBr=MgBr2+H2
网址:http://m.1010jiajiao.com/timu3_id_362639[举报]
海水中不仅含有丰富的非金属元素资源,(如Cl,Br,I等),还含有丰富的金属元素资源(如Na,Mg,Fe,Cr等),
(1)海水晒盐的原理是: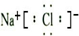
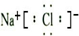 ;与Na,Cl同周期,且简单离子半径最小的离子结构示意图:
;与Na,Cl同周期,且简单离子半径最小的离子结构示意图:
(2)晒出的粗盐常混有MgSO4,CaSO4等杂质,为了得到精制盐,则提纯过程操作步骤和加入试剂的顺序是:①溶解,②
(3)晒盐得到的母液(盐卤)中含有丰富的镁元素,但其中常混有Fe2+,Cr3+等,为富集镁使其转化力MgCl2晶体.
有关资料:
为了有效除去杂质离子,又不引入新的杂质离子,且能满足“绿色化学理念”,则最佳试剂选择和操作是:
①先加
②再加
③过滤后,为能得到纯净MgCl2晶体,采用的操作方法是:
查看习题详情和答案>>
(1)海水晒盐的原理是:
蒸发结晶
蒸发结晶
;写出氯化钠的电子式: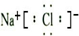
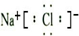
(2)晒出的粗盐常混有MgSO4,CaSO4等杂质,为了得到精制盐,则提纯过程操作步骤和加入试剂的顺序是:①溶解,②
加过量氯化钡溶液
加过量氯化钡溶液
,③加过量Na2CO3溶液,④加过量氢氧化钠溶液
加过量氢氧化钠溶液
.⑤过滤除去杂质,⑥加稀盐酸于滤液中至酸性
加稀盐酸于滤液中至酸性
,⑦蒸发结晶;(3)晒盐得到的母液(盐卤)中含有丰富的镁元素,但其中常混有Fe2+,Cr3+等,为富集镁使其转化力MgCl2晶体.
有关资料:
| M(OH)n | pH | |
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mg(OH)2 | 9.5 | 11.0 |
| Cr(OH)3 | 4.3 | 5.0 |
①先加
H2O2
H2O2
;目的是将Fe2+氧化成Fe3+
将Fe2+氧化成Fe3+
;②再加
MgO
MgO
;目的是调节溶液PH至5.0<PH<9.5,使杂质离子完全沉淀
调节溶液PH至5.0<PH<9.5,使杂质离子完全沉淀
,③过滤后,为能得到纯净MgCl2晶体,采用的操作方法是:
加盐酸,在酸性环境蒸发结晶,防止水解
加盐酸,在酸性环境蒸发结晶,防止水解
.