摘要:19.多硫化物S在碱性溶液中被BrO氧化为SO.而BrO被还原为Br-.在反应中消耗BrO和OH-的物质的量之比为2 : 3.则 (1)X的值为 . (2)反应的离子方程式 . (3)此反应的还原剂与氧化剂物质的量之比是 .
网址:http://m.1010jiajiao.com/timu3_id_362522[举报]
多硫化物S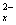 (x=2~6),在碱性溶液中被BrO
(x=2~6),在碱性溶液中被BrO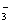 氧化成SO
氧化成SO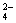 ,而BrO
,而BrO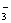 被氧化成SO
被氧化成SO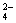 ,而BrO
,而BrO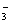 被还原成Br-。在反应中BrO
被还原成Br-。在反应中BrO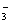 和OH-的物质的量之比为2∶3,则x值为________,其反应的离子方程式为____
____
和OH-的物质的量之比为2∶3,则x值为________,其反应的离子方程式为____
____
查看习题详情和答案>>
多硫化物S![]() (x=2~6),在碱性溶液中被BrO
(x=2~6),在碱性溶液中被BrO![]() 氧化成SO
氧化成SO![]() ,而BrO
,而BrO![]() 被氧化成SO
被氧化成SO![]() ,而BrO
,而BrO![]() 被还原成Br-。在反应中BrO
被还原成Br-。在反应中BrO![]() 和OH-的物质的量之比为2∶3,则x值为________,其反应的离子方程式为____
____
和OH-的物质的量之比为2∶3,则x值为________,其反应的离子方程式为____
____
查看习题详情和答案>>
(6分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
|
|
|
|
|
|
|
|
| C | N | O | F |
|
|
| Si | P | S | Cl |
|
|
| Ge | As | Se | Br |
|
|
| Sn | Sb | Te | I |
|
|
| Pb | Bi | Po | At |
|
(1)非金属性最强的元素是 ,常用来做半导体材料的元素是 ;
(2)形成化合物种类最多的元素是 ,写出该元素最高价氧化物的化学式 ;
(3)根据元素周期律,请你预测(填“>”或“<”):酸性强弱H3AsO4 H3PO4,气态氢化物的稳定性AsH3 H2Se。
查看习题详情和答案>>
(6分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
|
|
|
|
|
|
|
|
|
C |
N |
O |
F |
|
|
|
Si |
P |
S |
Cl |
|
|
|
Ge |
As |
Se |
Br |
|
|
|
Sn |
Sb |
Te |
I |
|
|
|
Pb |
Bi |
Po |
At |
|
(1)非金属性最强的元素是 ,常用来做半导体材料的元素是 ;
(2)形成化合物种类最多的元素是 ,写出该元素最高价氧化物的化学式 ;
(3)根据元素周期律,请你预测(填“>”或“<”):酸性强弱H3AsO4 H3PO4,气态氢化物的稳定性AsH3 H2Se 。
查看习题详情和答案>>