摘要:SO2与Cl2的漂白性比较 两种气体虽都有漂白性.但原理及现象又不同.Cl2是由于溶于水生成的HClO有强氧化性 .将有色物质氧化成无色物质.褪色后不能恢复到原来颜色--永久漂白.而SO2是由于溶于水生成的H2SO3与有色物质直接结合.形成不稳定的无色化合物.褪色后在一定的条件下又能恢复原来的颜色--暂时漂白.
网址:http://m.1010jiajiao.com/timu3_id_362183[举报]
关于SO2与Cl2的漂白性,下列说法正确的是,( )
A.SO2和Cl2都能使品红溶液褪色
B.SO2能使品红溶液褪色,Cl2却不能
C.Cl2能使石蕊试液褪色,SO2却不能
D.SO2、Cl2都不能使石蕊试液褪色
查看习题详情和答案>>
关于SO2与Cl2的漂白性,下列说法正确的是,( )
A.SO2和Cl2都能使品红溶液褪色
B.SO2能使品红溶液褪色,Cl2却不能
C.Cl2能使石蕊试液褪色,SO2却不能
D.SO2、Cl2都不能使石蕊试液褪色
查看习题详情和答案>>
某化学实验小组为了验证SO2和Cl2的漂白性,设计了如下图所示的实验装置.请回答下列问题:
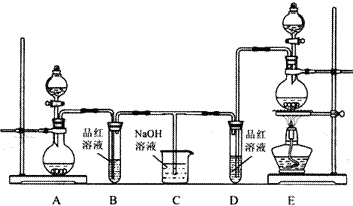
(1)他们制备SO2和Cl2所依据的原理分别是:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑、MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是 (填序号),反应中盐酸所表现的性质是 ;
(2)反应开始后,发现B、D试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的溶液加热,B试管中的现象是 ;
(3)装置C的作用是 ;
(4)NaOH(足量)溶液分别与两种气体反应的离子方程式是 、 ;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色.查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见酸,因而失去漂白作用.该反应的化学方程式为 .
查看习题详情和答案>>

(1)他们制备SO2和Cl2所依据的原理分别是:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑、MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,则上图A、E装置中用来制Cl2的装置是
(2)反应开始后,发现B、D试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的溶液加热,B试管中的现象是
(3)装置C的作用是
(4)NaOH(足量)溶液分别与两种气体反应的离子方程式是
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色.查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见酸,因而失去漂白作用.该反应的化学方程式为
某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
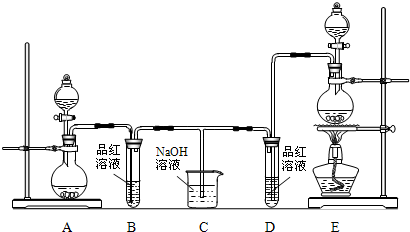
(1)他们制备Cl2依据的原理是:MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑,应选用上图A、E装置中的
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是
(3)NaOH溶液分别与两种气体反应的离子方程式是
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色.查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是
查看习题详情和答案>>

(1)他们制备Cl2依据的原理是:MnO2+4HCl(浓)
| ||
E
E
(填序号)制Cl2,反应中浓盐酸所表现出的性质是酸性
酸性
、还原性
还原性
.(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是
溶液由无色变为红色
溶液由无色变为红色
.(3)NaOH溶液分别与两种气体反应的离子方程式是
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
、SO2+2OH-=SO32-+H2O
SO2+2OH-=SO32-+H2O
.(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色.查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是
Cl2+SO2+2H2O=H2SO4+2HCl
Cl2+SO2+2H2O=H2SO4+2HCl
.