摘要:(四)定量认识有机物之间的相互反应. 在学习有机物的化学性质.制备和检验时.都要涉及有关的反应.对待反应的化学方程式.除了明确反应物.生成物的组成和结构以及反应条件等定性内容之外.还必须同时明确各物质之间的定量关系.不断强化理解学习的定量意识.现通过一些具体反应.举例说明如下: (1)在烷烃和芳香烃与卤素()的一卤取代反应中.被取代的H原子和卤素单质及生成的卤代烃物质的量之比为1∶1∶1. (2)在不饱和烃与氢气或卤素的加成反应中.C=C双键与氢气或卤素单质的量之比都是1∶1.若是C≡C叁键.则为1∶2 (3)当醇与金属钠反应时.醇羟基和反应消耗的Na及生成氢气物质的举之比为2∶2∶1.若醇羟基换成酚羟基或羰基.与金属钠反应时.也有同样的量关系. (4)当醇被氧化成醛或酮时.反应中被氧化的醇羟基和消耗的与生成C=O双键.物质的量之比为2∶1.2∶2,若将氧化剂换成CuO.上述量关系为1∶1∶1∶1. (5)在银镜反应中.醛基和消耗的与生成的羟基.析出Ag物质的量之比为1∶2:1∶2. 在醛和新制的浊液反应时.醛基.和生成的羰基.物质的量之比为1∶2:2∶1. 完全燃烧的反应中.有机物和消耗的氧气.与生成的.物质的量之比为: .
网址:http://m.1010jiajiao.com/timu3_id_361412[举报]
(2009?龙岩一模)测定平衡常数对定量认识化学反应具有重要意义.已知:碘单质能与I-反应成I3-,并在溶液中建立如下平衡:I2+I-?I3-.通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数.
I、某同学为测定上述平衡体系中c(I2),采用如下方法:取V1 mL平衡混合溶液,用c mol?L-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液.根据V1、V2和c可求得c(I2).
(1)上述滴定时,可采用
(2)下列对该同学设计方案的分析,正确的是
A.方案可行.能准确测定溶液中的c(I2)
B.不可行.因为I-能与Na2S2O3发生反应
C.不可行.只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、科研实践中可采用下述方法来测定该反应的平衡常数(室温条件下进行):
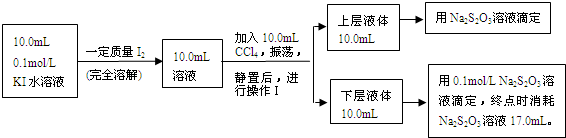
已知:①I-和I3-不溶于CCl4;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85.
回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是
(4)下层液体中碘单质的物质的量浓度是
(5)实验测得上层溶液中c(I3-)=0.049mol?L-1,结合上述有关数据,计算室温条件下反应I2+I-?I3-的平衡常数K=
(用具体数据列出计算式即可).
查看习题详情和答案>>
I、某同学为测定上述平衡体系中c(I2),采用如下方法:取V1 mL平衡混合溶液,用c mol?L-1的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液.根据V1、V2和c可求得c(I2).
(1)上述滴定时,可采用
淀粉
淀粉
做指示剂,滴定终点的现象是溶液由蓝色变无色
溶液由蓝色变无色
.(2)下列对该同学设计方案的分析,正确的是
C
C
(填字母).A.方案可行.能准确测定溶液中的c(I2)
B.不可行.因为I-能与Na2S2O3发生反应
C.不可行.只能测得溶液中c(I2)与c(I3-)之和
Ⅱ、科研实践中可采用下述方法来测定该反应的平衡常数(室温条件下进行):

已知:①I-和I3-不溶于CCl4;②一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
| c[I2(CCl4)] |
| c[I2(H2O)] |
回答下列问题:
(3)操作Ⅰ使用的玻璃仪器中,除烧杯、玻璃棒外,还需要的仪器是
分液漏斗
分液漏斗
(填名称).(4)下层液体中碘单质的物质的量浓度是
0.085mol/L
0.085mol/L
.(5)实验测得上层溶液中c(I3-)=0.049mol?L-1,结合上述有关数据,计算室温条件下反应I2+I-?I3-的平衡常数K=
| 0.049mol/L |
| 0.001mol/L×0.051mol/L |
| 0.049mol/L |
| 0.001mol/L×0.051mol/L |
 (2013?洛阳二模)如图是四种常见有机物的比例模型示意图.有关下列说法正确的是( )
(2013?洛阳二模)如图是四种常见有机物的比例模型示意图.有关下列说法正确的是( )