网址:http://m.1010jiajiao.com/timu3_id_361322[举报]
 镁、铝、铁及其化合物在生产和生活中有广泛的应用.
镁、铝、铁及其化合物在生产和生活中有广泛的应用.(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg):n(Al)=
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料.取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应).该硫铁矿中FeS2的质量分数为
(3)现有一定量的铁粉和铝粉组成的混合物跟100mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00mol?L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是
(4)炼铁厂生产的生铁常用于炼钢.取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下).
①计算此钢样粉末中铁和碳的物质的量之比为
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如表所示:
| 实验序号 | I | II | III |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
③若在上述实验II中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为
| 0.12 |
| 28.12 |
m>1.406g时,(m-1.376)g
| 0.12 |
| 28.12 |
m>1.406g时,(m-1.376)g
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol?L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁:向步骤Ⅱ所得溶液中加入过量氨水.
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答:
(1)步骤Ⅱ中,可用于调节溶液pH至7~8的最佳试剂是
A.MgO B.Na2CO3 C.蒸馏水
(2)检验粗硫酸镁溶液中Fe2+的方法是:
(3)步骤Ⅲ中制备氢氧化镁反应的离子方程式为
(4)步骤Ⅱ沉淀后溶液中主要存在(NH4)2SO4,已知室温下0.1mol?L-1的(NH4)2SO4溶液pH是5,则溶液中离子浓度由大到小的排列为
(5)某生产科研小组经查阅资料得到以下溶度积Ksp数据(298K时):
Mg(OH)2(S)?Mg2+(aq)+2OH-(aq) Ksp=[Mg2+]?[OH-]2=5.6×10-12
Ca(OH)2(S)?Ca2+(aq)+2OH-(aq) Ksp=[Ca2+]?[OH-]2=4.7×10-6
该科研小组认为可以用熟石灰替代氨水制得氢氧化镁,他们的理由是
若沉淀转化反应为:Mg2+(aq)+Ca(OH)2(S)?Mg(OH)2(S)+Ca2+(aq),求此温度下该反应的化学平衡常数K=
镁、铝、铁及其化合物在生产和生活中有广泛的应用。
(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg): n(Al)= 。
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料。取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为 。
(3)现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是 。

(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下)。
①计算此钢样粉末中铁和碳的物质的量之比为 (最简单的整数比)。
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
加入钢样粉末的质量(g) |
2.812 |
5.624 |
8.436 |
|
生成气体的体积(L)(标准状况) |
1.120 |
2.240 |
2.800 |
则该硫酸溶液的物质的量浓度为 。
③若在上述实验Ⅱ中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为 g (保留3位小数)
查看习题详情和答案>>
(14分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁4%~6%的铝镁合金(不含其它元素)中镁的质量分数,设计了多种实验方案,其中之一是:将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。按要求填写下列空白:
1.称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。
⑴实验中发生反应的化学方程式是 。
⑵为使其反应完全,则NaOH溶液的体积V ≥ mL。
2.过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 。
(填“偏高”、“偏低”或“无影响”)。
3. NaOH溶液的浓度可用稀硫酸测定,欲用质量分数98%(密度为1.84 g/cm3)的浓硫酸配制3 mol/L的稀硫酸100 mL。回答下列问题:
⑴需要用量筒量取浓硫酸 mL。
⑵配制操作可分解成如下几步,正确的操作顺序是 。
A.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2cm时。
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次。
C.将冷却的稀硫酸转移到容量瓶中。
D.根据计算,用量筒取一定体积的浓硫酸。
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌。
F.盖上容量瓶塞子,振荡,摇匀。
G.用胶头滴管加蒸馏水,使溶液凹液面恰好与刻度线相切
⑶下列操作,使制得的稀硫酸溶液浓度偏小的是 (填写编号)。
A.用量筒量取一定液体时,俯视液面读数。
B.在容量瓶定容时俯视刻度线。
C.转移溶液后未洗涤烧杯和玻璃棒。
D.容量瓶刚用蒸馏水洗净,没有烘干。
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切。
查看习题详情和答案>>
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2Mg0.B203.H20、 Si02及少量Fe304、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下:
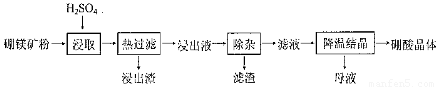
已知:H3BO3在200C、400C、600C、1000C时的溶解度依次为5.0 g、8.7 g、14.8 g、 40. 2 g。Fe3 +、Al3 +、Fe2 +和Mg2 +以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、 5.2、9.7和 12.4。
(1)由于矿粉中含CaC03,为防止“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施是: ??????????????????????????????????????????????????????????????????????????????????? 。
(2)“浸出液”显酸性,含H3B03和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H202和Mg0,除去的杂质离子是_______。H2O2的作用是____________________________________________ (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是_____________________________________。
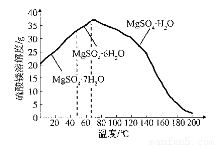
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶 液的沸点随压强增大而升高。为了从“母液”中充分回收MgS04·H20,应采取的 措施是将“母液”蒸发浓缩,____________
(5)硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4]-(aq)+H+(aq)?? K=5.7×10-10(298K)
[B(OH)4]-(aq)+H+(aq)?? K=5.7×10-10(298K)
计算25℃时0.7mol·L-1 硼酸溶液中H+的浓度。(写出计算过程)
(6)已知298K时:
化学式 | 碳酸 | 醋酸 |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是??????????????? 。
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸中能观察到有气泡产生
C.等浓度的碳酸和硼酸溶液比较,pH:前者>后者
D.等浓度的碳酸钠和醋酸钠溶液比较,pH:前者>后者
查看习题详情和答案>>