摘要:在常温下.有体积为m升.pH值为a的稀硫酸和pH值为b.体积为n升的烧碱溶液混和后.溶液呈中性. (1)如果a+b=14.则m/n= (2)如果a+b=13.则m/n= (3)如果a+b>14.则m/n= .且m
网址:http://m.1010jiajiao.com/timu3_id_361261[举报]
(2010?济南一模)下列为元素周期表的一部分,表中阿拉伯数字(1、2…)是原周期表中行或列的序号.请参照元素A~I在表中的位置,回答下列问题.
(1)B、C两元素中非金属性较强的是
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:
(4)I元素在周期表里的位置在第
实验室中采用如图所示装置模拟工业上同时制取元素A和I的单质过程:
①写出电极C1上发生反应的电极反应式
②当电极上产生112mL(标准状况)元素I单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=
查看习题详情和答案>>
| 纵行 | 1 | 18 | ||||||
| 横行 | ||||||||
| 1 | A | 2 | 13 | 14 | 15 | 16 | 17 | |
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | ||||
氮
氮
(写出元素名称),请设计一个简单的实验证明这一结论取碳酸钠或碳酸氢钠溶液置于试管中,向其中滴加稀硝酸,观察是否有无色无味的气体产生,HNO3+NaHCO3═NaNO3+H2O+CO2↑
或2HNO3+Na2CO3═2NaNO3+H2O+CO2↑
或2HNO3+Na2CO3═2NaNO3+H2O+CO2↑
取碳酸钠或碳酸氢钠溶液置于试管中,向其中滴加稀硝酸,观察是否有无色无味的气体产生,HNO3+NaHCO3═NaNO3+H2O+CO2↑
或2HNO3+Na2CO3═2NaNO3+H2O+CO2↑
.或2HNO3+Na2CO3═2NaNO3+H2O+CO2↑
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
Al2O3+2OH-═2AlO2-+H2O
Al2O3+2OH-═2AlO2-+H2O
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:
2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2H2O═4NaOH+O2↑
.(4)I元素在周期表里的位置在第
三
三
周期、第VIIA
VIIA
族.
实验室中采用如图所示装置模拟工业上同时制取元素A和I的单质过程:
①写出电极C1上发生反应的电极反应式
2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
.②当电极上产生112mL(标准状况)元素I单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=
13
13
.(KW=1.00×10-14)复分解反应存在这样一个规律:较强酸可制取较弱酸.中和反应、盐类的水解也是复分解反应,盐类的水解反应的逆反应是中和反应.盐类的水解反应中,弱酸强碱盐中弱酸根离子对应的弱酸越弱,其盐越容易发生水解.
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
(1)请根据上述信息判断下列反应不能发生的是
A.CO2+H2O+2NaClO═Na2CO3+2HClO
B.CO2+H2O+NaClO═NaHCO3+HClO
C.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa-→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
F.CH3COOH+NaCN═CH3COONa+HCN
(2)一些复分解反应的发生还遵循其他的规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.
根据上述反应,总结出复分解反应发生的另一规律为
(3)物质的量浓度均为0.05mol/L的下列五种物质的溶液中,pH由大到小的顺序是
①C6H5OH(苯酚) ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(4)一定温度下,向等体积纯水中分别加入等物质的量的下列物质:①NaOH、②CH3COOH、③NaClO,则水的电离程度最大的是
(5)25℃时,M酸溶液的pH=a,N碱溶液的pH=b.
①若X为强酸,Y为强碱,且a+b=14,若两者等体积混合后,溶液的pH=
②若X的化学式为HR,Y的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性,则混合溶液中必定有一种离子能发生水解,该离子为
a c(MOH)>c(M+)>c(R-)>c(H+)>c(OH-)
b c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
c c(R-)>c(M+)>c(H+)>c(OH-)
d c(M+)>c(R-)>c(OH-)>c(H+)
e c(M+)+c(H+)=c(R-)+c(OH-)
查看习题详情和答案>>
已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 8.1 | 11.6 | 10.3 | 11.1 | 11.3 |
AD
AD
(填编号).A.CO2+H2O+2NaClO═Na2CO3+2HClO
B.CO2+H2O+NaClO═NaHCO3+HClO
C.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa-→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
F.CH3COOH+NaCN═CH3COONa+HCN
(2)一些复分解反应的发生还遵循其他的规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液
②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体
③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.
根据上述反应,总结出复分解反应发生的另一规律为
反应能够由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行
反应能够由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行
.(3)物质的量浓度均为0.05mol/L的下列五种物质的溶液中,pH由大到小的顺序是
①④②③⑤
①④②③⑤
(填编号).①C6H5OH(苯酚) ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(4)一定温度下,向等体积纯水中分别加入等物质的量的下列物质:①NaOH、②CH3COOH、③NaClO,则水的电离程度最大的是
③
③
(填编号).(5)25℃时,M酸溶液的pH=a,N碱溶液的pH=b.
①若X为强酸,Y为强碱,且a+b=14,若两者等体积混合后,溶液的pH=
7
7
,此时溶液中金属阳离子浓度大于酸根阴离子浓度,其原因可能是酸为二元强酸,碱为一元强碱
酸为二元强酸,碱为一元强碱
.②若X的化学式为HR,Y的化学式为MOH,且a+b=14,两者等体积混合后溶液显酸性,则混合溶液中必定有一种离子能发生水解,该离子为
R-
R-
(填离子符号);混合后的溶液中,下列微粒浓度大小关系正确的是c e
c e
(填序号).a c(MOH)>c(M+)>c(R-)>c(H+)>c(OH-)
b c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
c c(R-)>c(M+)>c(H+)>c(OH-)
d c(M+)>c(R-)>c(OH-)>c(H+)
e c(M+)+c(H+)=c(R-)+c(OH-)
现有X、Y、Z、W四种元素,其原子序数依次递增.已知有如下情况:
①X、Y、Z的单质在常温下均为气体.
②X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色.
③XZ极易溶于水,在水溶液中电离出X+和Z-.XZ的水溶液可使石蕊试液变红.
④两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体.
⑤Z的单质溶于X2Y中,所得溶液具有漂白作用.
⑥由Y、Z、W三种元素组成的化合物M受热催化分解,可制得元素Y的单质.
请完成下列问题:
(1)化合物M的化学式为
(2)用化学方程式表示Z单质的实验室检验方法
(3)写出Z的单质溶于X2Y中反应的化学方程式:
查看习题详情和答案>>
①X、Y、Z的单质在常温下均为气体.
②X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色.
③XZ极易溶于水,在水溶液中电离出X+和Z-.XZ的水溶液可使石蕊试液变红.
④两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体.
⑤Z的单质溶于X2Y中,所得溶液具有漂白作用.
⑥由Y、Z、W三种元素组成的化合物M受热催化分解,可制得元素Y的单质.
请完成下列问题:
(1)化合物M的化学式为
KClO3
KClO3
,1mol M中含有的电子的物质的量为60
60
mol.(2)用化学方程式表示Z单质的实验室检验方法
Cl2+2KI=2KCl+I2
Cl2+2KI=2KCl+I2
.(3)写出Z的单质溶于X2Y中反应的化学方程式:
Cl2+H2O=HClO+HCl
Cl2+H2O=HClO+HCl
,若该反应中有2mol电子发生转移,则参加反应的Z单质在标况下的体积为44.8
44.8
L.在常温、常压下R为气体单质,B、M为固体单质,A、C、D、E、F、H为化合物,A、C为气体,它们之间的相互转换关系如下图所示(反应所需条件未注明,某些反应已将水等次要产物略去)
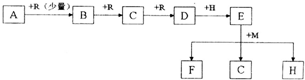
请回答下列问题:
(1)实验室快速制取少量R的方程式为
(2)若F溶于水得到蓝色溶液,则M为
(A)V<10.08
(B)因为M为足量,可以计算出被还原的E的物质的量为0.45mol
(C)被氧化的M的质量为
g
(D)若将生成的气体C通入紫色石蕊试液中,溶液先变红,最终褪为无色.
(E)可以用BaCl2溶液来检验最终溶液中E有无剩余.
(3)若M为短周期元素形成的黑色固体单质,实验室利用下图装置检验E和M在加热条件下反应所得全部产物.
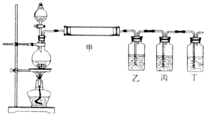
①装置甲中应加的试剂是
②装置乙、丙和丁中所加试剂分别是
(A)澄清石灰水、品红溶液、高锰酸钾酸性溶液
(B)品红溶液、高锰酸钾酸性溶液、澄清石灰水
(C)澄清石灰水、高锰酸钾酸性溶液、品红溶液
③在实验中如果将丙去掉,
④如果将烧瓶中产生的气体混合物分别通入Ba(NO3)2溶液和BaCl2溶液中,二者现象
相同(4)若M为短周期元素形成的单质,用它制作的容器在常温下能够盛放E的浓溶液.请写出M的单质与E的浓溶液剧烈反应的化学方程式
查看习题详情和答案>>

请回答下列问题:
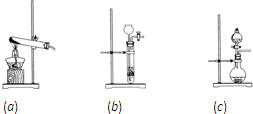
(1)实验室快速制取少量R的方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
,发生装置可以选取下列装置中的
| ||
C
C
(填字母)
(2)若F溶于水得到蓝色溶液,则M为
Cu
Cu
,E与M反应的化学方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
,取50ml物质的量浓度为18mol?L-1的E溶液与足量的M在加热条件下充分反应,得到气体C在标准状况下的体积为V L,下列说法中正确的是:
| ||
A、C
A、C
(A)V<10.08
(B)因为M为足量,可以计算出被还原的E的物质的量为0.45mol
(C)被氧化的M的质量为
| 20V |
| 7 |
(D)若将生成的气体C通入紫色石蕊试液中,溶液先变红,最终褪为无色.
(E)可以用BaCl2溶液来检验最终溶液中E有无剩余.
(3)若M为短周期元素形成的黑色固体单质,实验室利用下图装置检验E和M在加热条件下反应所得全部产物.

①装置甲中应加的试剂是
无水硫酸铜
无水硫酸铜
;②装置乙、丙和丁中所加试剂分别是
B
B
(填下列选项的字母序号)(A)澄清石灰水、品红溶液、高锰酸钾酸性溶液
(B)品红溶液、高锰酸钾酸性溶液、澄清石灰水
(C)澄清石灰水、高锰酸钾酸性溶液、品红溶液
③在实验中如果将丙去掉,
不能
不能
(填“能”或“不能”)达到实验目的,原因是SO2也能使澄清石灰水变浑浊,必须先除尽SO2后再检验CO2,以防SO2的干扰
SO2也能使澄清石灰水变浑浊,必须先除尽SO2后再检验CO2,以防SO2的干扰
.④如果将烧瓶中产生的气体混合物分别通入Ba(NO3)2溶液和BaCl2溶液中,二者现象
不会
不会
(填“会”或“不会”).相同(4)若M为短周期元素形成的单质,用它制作的容器在常温下能够盛放E的浓溶液.请写出M的单质与E的浓溶液剧烈反应的化学方程式
2Al+6H2SO4(浓)
Al2(SO4)3+3SO2↑+6H2O
| ||
2Al+6H2SO4(浓)
Al2(SO4)3+3SO2↑+6H2O
.
| ||
(8分)现有X、Y、Z、W四种元素,其原子序数依次递增。已知有如下情况:
①X、Y、Z的单质在常温下均为气体。
② X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
③ XZ极易溶于水,在水溶液中电离出X+和Z-。XZ的水溶液可使石蕊试液变红。
④ 两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体。
⑤ Z的单质溶于X2Y中,所得溶液具有漂白作用。
⑥由Y、Z、W三种元素组成的化合物M受热催化分解,可制得元素Y的单质。
请完成下列问题:
(1)化合物M的化学式为 ▲ ,1molM中含有的电子的物质的量为 ▲ 。
(2)用化学方程式表示Z单质的实验室检验方法 ▲ 。
(3)写出Z的单质溶于X2Y中反应的化学方程式: ▲ ,若该反应中有2mol电子发生转移,则参加反应的Z单质在标况下的体积为 ▲ 。
查看习题详情和答案>>