摘要:在密闭容器内发生反应2NO2(g) ==== N2O4(g).达到平衡后.能使容器内颜色变浅的是( ) A.将容器体积缩小一半 B.升高温度 C.将容器体积增大一倍 D.充入少量NO2
网址:http://m.1010jiajiao.com/timu3_id_360761[举报]
在恒温、恒容的密闭容器中发生反应:N2O4(g)====2NO2(g)。
(1)20 s内N2O4的浓度由0.1 mol·L-1降至0.06 mol·L-1,则v(NO2)=_______________ mol·(L·min)-1。
(2)若使N2O4的浓度继续由0.06 mol·L-1降至0.036 mol·L-1,若近似用(1)所求得的反应速率计算,后一段反应所需的时间t1为____________ s。
(3)后一段反应实际消耗时间t2____________t1(填“=”“<”或“>”)。
查看习题详情和答案>>在恒温、恒容的密闭容器中发生反应:N2O4(g)====2NO2(g)。
(1)20 s内N2O4的浓度由0.1 mol·L-1降至0.06 mol·L-1,则v(NO2)=_______________ mol·(L·min)-1。
(2)若使N2O4的浓度继续由0.06 mol·L-1降至0.036 mol·L-1,若近似用(1)所求得的反应速率计算,后一段反应所需的时间t1为____________ s。
(3)后一段反应实际消耗时间t2____________t1(填“=”“<”或“>”)。
查看习题详情和答案>>
在一个容积为2L的密闭容器中,保持一定的温度,发生反应:2NO2(g)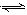 N2O4(g) ΔH<0。
N2O4(g) ΔH<0。
已知加入2molNO2,经过amin后达到平衡,测得N2O4的物质的量为0.5mol。
(1)反应从开始到平衡这段时间内NO2的平均反应速率为____________。
(2)下列叙述中,能够说明该反应已经达到平衡的是_______(填写序号)。
A.容器内压强不随时间而变化
B.混合气体的密度不随时间而变化
C.NO2物质的量不再改变
D.混合气体的平均相对分子质量不随时间而变化
E.混合气体的颜色不再改变
F.NO2的消耗速率等于N2O4生成速率的两倍
(3)在相同的实验条件下,若在另一个完全相同的容器中加入1.5molNO2和0.25molN2O4,经过bmin后达到平衡,此时N2O4的物质的量浓度为__________,比较a和b的大小:a_______b(填“>”、“<”或“=”)。
(4)若在原容器中再加入2molNO2,达到平衡后,此时NO2的体积分数与原平衡相比______(填“增大”、“减小”或“不变”);在此基础上降低温度,混合气体的颜色变化:__________(填“变深”、“变浅”或“无法确定”,下同),与加入2molNO2之前的原平衡相比,混合气体的颜色变化:__________。 查看习题详情和答案>>
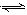 N2O4(g) ΔH<0。
N2O4(g) ΔH<0。已知加入2molNO2,经过amin后达到平衡,测得N2O4的物质的量为0.5mol。
(1)反应从开始到平衡这段时间内NO2的平均反应速率为____________。
(2)下列叙述中,能够说明该反应已经达到平衡的是_______(填写序号)。
A.容器内压强不随时间而变化
B.混合气体的密度不随时间而变化
C.NO2物质的量不再改变
D.混合气体的平均相对分子质量不随时间而变化
E.混合气体的颜色不再改变
F.NO2的消耗速率等于N2O4生成速率的两倍
(3)在相同的实验条件下,若在另一个完全相同的容器中加入1.5molNO2和0.25molN2O4,经过bmin后达到平衡,此时N2O4的物质的量浓度为__________,比较a和b的大小:a_______b(填“>”、“<”或“=”)。
(4)若在原容器中再加入2molNO2,达到平衡后,此时NO2的体积分数与原平衡相比______(填“增大”、“减小”或“不变”);在此基础上降低温度,混合气体的颜色变化:__________(填“变深”、“变浅”或“无法确定”,下同),与加入2molNO2之前的原平衡相比,混合气体的颜色变化:__________。 查看习题详情和答案>>
在恒温、恒容的密闭容器中发生反应:N2O4(g)====2NO2(g)。
(1)20 s内N2O4的浓度由0.1 mol·L-1降至0.06 mol·L-1,则v(NO2)="_______________" mol·(L·min)-1。
(2)若使N2O4的浓度继续由0.06 mol·L-1降至0.036 mol·L-1,若近似用(1)所求得的反应速率计算,后一段反应所需的时间t1为____________ s。
(3)后一段反应实际消耗时间t2____________t1(填“=”“<”或“>”)。
(1)20 s内N2O4的浓度由0.1 mol·L-1降至0.06 mol·L-1,则v(NO2)="_______________" mol·(L·min)-1。
(2)若使N2O4的浓度继续由0.06 mol·L-1降至0.036 mol·L-1,若近似用(1)所求得的反应速率计算,后一段反应所需的时间t1为____________ s。
(3)后一段反应实际消耗时间t2____________t1(填“=”“<”或“>”)。
已知反应:N2O4(g) 2NO2(g) △H>0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示:请回答下列问题:
2NO2(g) △H>0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示:请回答下列问题:
 2NO2(g) △H>0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示:请回答下列问题:
2NO2(g) △H>0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示:请回答下列问题:
(1)a、b、c、d四点中,表示上述反应处于平衡状态的点是_______。
(2)前10 min内用NO2表示的化学反应速率v(NO2)=______mol·L-1·min-1。上述反应在第一个平衡点的平衡常数K1=________。上述反应在第二个平衡点的平衡常数K2与第一个平衡点的平衡常数K1的关系:
K1______ (填“>”、“<”或“=”)K2。
(3)反应进行到25 min时,增加了_______mol______(填物质的化学式),使平衡发生了移动。
查看习题详情和答案>>
(2)前10 min内用NO2表示的化学反应速率v(NO2)=______mol·L-1·min-1。上述反应在第一个平衡点的平衡常数K1=________。上述反应在第二个平衡点的平衡常数K2与第一个平衡点的平衡常数K1的关系:
K1______ (填“>”、“<”或“=”)K2。
(3)反应进行到25 min时,增加了_______mol______(填物质的化学式),使平衡发生了移动。