网址:http://m.1010jiajiao.com/timu3_id_360350[举报]
(1)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用.精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是
(2)如图是离子交换膜(允许钠离子通过,不允许氢氧根与氯离子通过)法电解饱和食盐水示意图,电解槽阳极产生的气体是
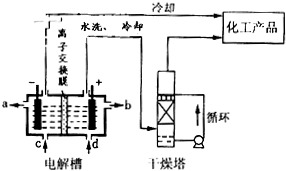
Ⅱ.多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注.
(1)SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为
| ||
| ||
(2)SiCl4可转化为SiHCl3而循环使用.一定条件下,在20L恒容密闭容器中的反应:
3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为
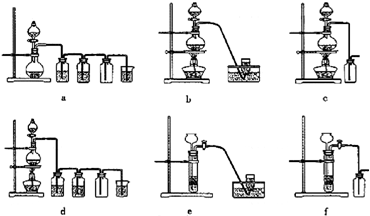
(3)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4→ZnSO4+H2↑;MnO2+4HCl(浓)
| △ |
据此,从下列所给仪器装置中选择制备并收集H2的装置
可选用制备气体的装置:
(4)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
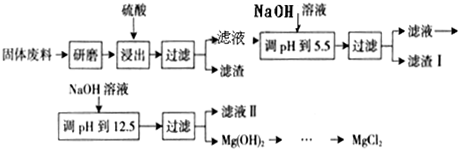
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(2)滤渣I的主要成分是
Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3→Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如图所示:
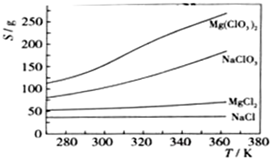
(3)将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因:
(4)按题(3)中条件进行制备实验.在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
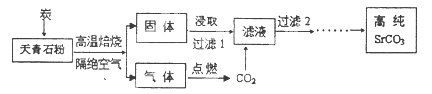
元素锶(Sr)位于周期表第5周期第IIA族。碳酸锶(SrCO3)被广泛用于彩色电视机的阴极射线管。以天青石(主要成分为SrSO4,含不溶性杂质)为原料制取高纯碳酸锶的“煅烧浸取法”部分工艺流程示意如下。
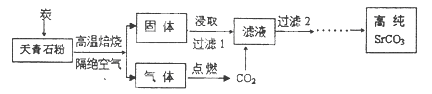
(1)写出与元素锶同族第3周期元素的原子结构示意图: 。
(2)隔绝空气高温焙烧中,若0.5mol SrSO4中只有S被还原,转移了4mol电子。写出该反应的化学方程式: 。
(3)制取高纯碳酸锶过程中,常用乙醇胺(HOCH2CH2NH2)作为CO2吸收剂。乙醇胺水溶液显弱碱性(与NH3溶于水原理相似),原因是 (用离子方程式表示)。
(4)该流程中过滤2之后还有除杂等多步操作,其中最后两步是 。
(5)“低温湿法”是一种制取碳酸锶的方法:将天青石粉末与碳酸钠溶液混合,70oC下加热1~2h后,经一系列操作,得到碳酸锶。主要反应为:
 SrSO4(s)+CO
SrSO4(s)+CO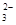 (aq)
SrCO3(s)+SO
(aq)
SrCO3(s)+SO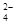 (aq)
(aq)
[已知:70oC时,Ksp(SrSO4)=3.3×10-7,Ksq(SrCO3)=1.1×10-10]
上述反应的平衡常数K= 。
(6)通过“低温湿法”得到的碳酸锶纯度较低,可能的原因是 (写一种)。
查看习题详情和答案>>
元素锶(Sr)位于周期表第5周期第IIA族。碳酸锶(SrCO3)被广泛用于彩色电视机的阴极射线管。以天青石(主要成分为SrSO4,含不溶性杂质)为原料制取高纯碳酸锶的“煅烧浸取法”部分工艺流程示意如下。
(1)写出与元素锶同族第3周期元素的原子结构示意图: 。
(2)隔绝空气高温焙烧中,若0.5mol SrSO4中只有S被还原,转移了4mol电子。写出该反应的化学方程式: 。
(3)制取高纯碳酸锶过程中,常用乙醇胺(HOCH2CH2NH2)作为CO2吸收剂。乙醇胺水溶液显弱碱性(与NH3溶于水原理相似),原因是 (用离子方程式表示)。
(4)该流程中过滤2之后还有除杂等多步操作,其中最后两步是 。
(5)“低温湿法”是一种制取碳酸锶的方法:将天青石粉末与碳酸钠溶液混合,70oC下加热1~2h后,经一系列操作,得到碳酸锶。主要反应为: SrSO4(s)+CO
SrSO4(s)+CO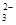 (aq) SrCO3(s)+SO
(aq) SrCO3(s)+SO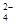 (aq)
(aq)
[已知:70oC时,Ksp(SrSO4)=3.3×10-7,Ksq(SrCO3)=1.1×10-10]
上述反应的平衡常数K= 。
(6)通过“低温湿法”得到的碳酸锶纯度较低,可能的原因是 (写一种)。
(1)写出与元素锶同族第3周期元素的原子结构示意图: 。
(2)隔绝空气高温焙烧中,若0.5mol SrSO4中只有S被还原,转移了4mol电子。写出该反应的化学方程式: 。
(3)制取高纯碳酸锶过程中,常用乙醇胺(HOCH2CH2NH2)作为CO2吸收剂。乙醇胺水溶液显弱碱性(与NH3溶于水原理相似),原因是 (用离子方程式表示)。
(4)该流程中过滤2之后还有除杂等多步操作,其中最后两步是 。
(5)“低温湿法”是一种制取碳酸锶的方法:将天青石粉末与碳酸钠溶液混合,70oC下加热1~2h后,经一系列操作,得到碳酸锶。主要反应为:
 SrSO4(s)+CO
SrSO4(s)+CO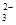 (aq) SrCO3(s)+SO
(aq) SrCO3(s)+SO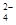 (aq)
(aq)[已知:70oC时,Ksp(SrSO4)=3.3×10-7,Ksq(SrCO3)=1.1×10-10]
上述反应的平衡常数K= 。
(6)通过“低温湿法”得到的碳酸锶纯度较低,可能的原因是 (写一种)。
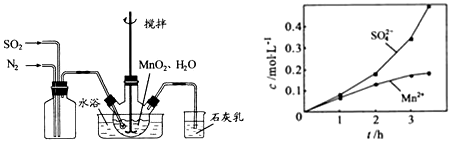
(1)制备MnSO4溶液:在烧瓶中加入一定MnO2和水,搅拌,通入SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤(已知MnO2 + H2SO3= MnSO4 + H2O)
①MnO2和水,搅拌,通入SO2的化学方程式为_________________________
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可用_____________
③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是_______________________
①__________________
②过滤,用少量水洗涤2~3次;
③是否被洗涤除去 检验SO42-
④________________
⑤低于100℃干燥
(3)向物质的量浓度均为0.01 mol·L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的是___________(填离子符号);当两种沉淀共存时,溶液中
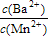 =__________。(已知Ksp(BaCO3)=8.1×10-9,Ksp(MnCO3)=1.8×10-11)
=__________。(已知Ksp(BaCO3)=8.1×10-9,Ksp(MnCO3)=1.8×10-11)