摘要:烷基锂在有机合成中是一种重要的中间试剂.甲基锂的晶体结构如图所示.锂原子居于四面体的四个顶点.甲基指向四面体的每一个面.每一个甲基于3个锂原子相连.从而形成(CH3Li)4的聚集体.在下图小圆圈中.分别写上“Li .“C 的符号. 答案:1. 0.5×10-10m 2. 平面三角形.120° 3. 3.n.1∶4 4.正四面体.Si2O76-.Si3O96- 5.1∶3∶1 6.47 7.没有 8.在.不在.有 9. 4
网址:http://m.1010jiajiao.com/timu3_id_359945[举报]
重氮甲烷(CH2←N≡N)在有机合成中有着重要的应用,它的分子中碳原子和氮原子之间的共用电子对是由氮原子提供的。
它在受热或光照时容易分解生成氮气,同时生成一个极活泼的缺电子基团亚甲基或称为碳烯(:CH2)。CH2←N≡N N2↑+:CH2;碳烯与烯烃或苯环能起加成反应,生成含三元环的化合物:
N2↑+:CH2;碳烯与烯烃或苯环能起加成反应,生成含三元环的化合物:
(1)重氮甲烷与结构简式为 的有机物在光照下反应生成 。
。
(2)重氮甲烷与苯共热完全反应生成的环状化合物的结构简式为 ,与该产物互为同分异构体的芳香烃共有 种,其中烷基上发生一氯取代的生成物只有一种的芳香烃的结构简式为 。
重氮甲烷(CH2←N≡N)在有机合成中有着重要的应用,它的分子中碳原子和氮原子之间的共用电子对是由氮原子提供的。
它在受热或光照时容易分解生成氮气,同时生成一个极活泼的缺电子基团亚甲基或称为碳烯(:CH2)。CH2←N≡N N2↑+:CH2;碳烯与烯烃或苯环能起加成反应,生成含三元环的化合物:
N2↑+:CH2;碳烯与烯烃或苯环能起加成反应,生成含三元环的化合物: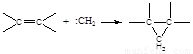
(1)重氮甲烷与结构简式为
的有机物在光照下反应生成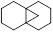 。
。
(2)重氮甲烷与苯共热完全反应生成的环状化合物的结构简式为 ,与该产物互为同分异构体的芳香烃共有 种,其中烷基上发生一氯取代的生成物只有一种的芳香烃的结构简式为 。
查看习题详情和答案>>
图表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式
(2)D的气态氢化物的VSEPR模型为
(3)G、H和I的第一电离能数值由大到小的顺序为:
(4)由A、C、D形成的ACD分子中,含有
(5)要证明太阳上是否含有R 元素,可采用的方法是
(6)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有
查看习题详情和答案>>

试回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
(2)D的气态氢化物的VSEPR模型为
三角锥型
三角锥型
,其中心原子的杂化类型为sp3杂化
sp3杂化
.(3)G、H和I的第一电离能数值由大到小的顺序为:
Mg>Al>Na
Mg>Al>Na
(用元素符号作答).(4)由A、C、D形成的ACD分子中,含有
2
2
个σ键,2
2
个π键.(5)要证明太阳上是否含有R 元素,可采用的方法是
光谱分析
光谱分析
.(6)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.请回答下列问题:
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有
K、Cu
K、Cu
(填元素符号)②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是
非极性
非极性
(填“极性”或“非极性”)分子.③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有
C2H4、CH2O
C2H4、CH2O
(填分子式).
氟、氯、溴、碘4种元素同属于元素周期表中ⅧA族.
(1)氯可广泛存在于无机物和有机物中.二氯甲烷(CH2Cl2)是甲烷分子中碳原子上连接的两个氢原子被两个氯原子取代形成的一种氯代物,其分子中碳原子轨道的杂化类型是 .氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是 (填“极性”或“非极性”)分子.
(2)冰晶石(Na3AlF6)主要用作电解Al2O3生产铝的助熔剂,其晶体不导电,但熔融时能导电.在冰晶石(Na3AlF6)晶体中存在 (填序号).
a.离子键 b.极性键
c.配位键 d.范德华力
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为 .已知其中一种化合物的化学式为KCuCl3,另一种化合物的化学式为 .

(4)氢氟酸是弱酸的原因是 .
(5)氰[(CN)2]是一种分子构型和化学性质与卤素单质相似的化合物,称为拟卤素.一个氰分子中含有 个π键.
查看习题详情和答案>>
(1)氯可广泛存在于无机物和有机物中.二氯甲烷(CH2Cl2)是甲烷分子中碳原子上连接的两个氢原子被两个氯原子取代形成的一种氯代物,其分子中碳原子轨道的杂化类型是
(2)冰晶石(Na3AlF6)主要用作电解Al2O3生产铝的助熔剂,其晶体不导电,但熔融时能导电.在冰晶石(Na3AlF6)晶体中存在
a.离子键 b.极性键
c.配位键 d.范德华力
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为

(4)氢氟酸是弱酸的原因是
(5)氰[(CN)2]是一种分子构型和化学性质与卤素单质相似的化合物,称为拟卤素.一个氰分子中含有
羟醛缩合反应在有机合成中颇为重要,绿色催化剂的固体铌酸倍受研究者关注.铌酸具有较高的催化活性及稳定性.反应原理如下:
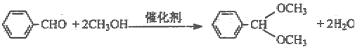
实验方法是在25mL烧瓶中加入铌酸.10mL甲醇和0.5mL甲醛,在回流状态下反应2h,反应的产率和转化率均非常高.
(1)采用回流反应2h的目的是 .
(2)在反应中甲醇需过量,其原因是 .
(3)不同铌酸用量对产率和转化率影响,如下表:
在上述苯甲醛与甲醇缩合反应实验中催化剂铌酸的最佳用量为 .
(4)催化剂的回收利用性能是考察催化剂的一项极为重要的指标.铌酸催化剂循环使用次数对产率的影响如图,这说明铌酸催化剂的优点之一是 .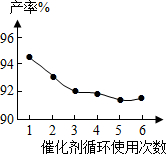
从表中得出的不同的醛与甲醇缩合反应影响转化率和产率的规律是 .
查看习题详情和答案>>

实验方法是在25mL烧瓶中加入铌酸.10mL甲醇和0.5mL甲醛,在回流状态下反应2h,反应的产率和转化率均非常高.
(1)采用回流反应2h的目的是
(2)在反应中甲醇需过量,其原因是
(3)不同铌酸用量对产率和转化率影响,如下表:
| 铌酸用量/mol | 0.01 | 0.02 | 0.03 | 0.05 | 0.1 | 0.15 | 0.2 | 0.6 |
| 产率% | 87.3 | 88.2 | 90.3 | 94.2 | 92.9 | 93.1 | 91.8 | 92.3 |
| 转化率% | 89.7 | 92.1 | 93.9 | 98.9 | 94.9 | 95.7 | 93.9 | 94.3 |
(4)催化剂的回收利用性能是考察催化剂的一项极为重要的指标.铌酸催化剂循环使用次数对产率的影响如图,这说明铌酸催化剂的优点之一是

| 序号 | 醛 | 醇 | 转化率% | 产率% |
| 1 | 邻羟基苯甲醛 | 甲醇 | 94.3 | 89.6 |
| 2 | 对羟基苯甲醛 | 甲醇 | 93.6 | 88.7 |
| 3 | 邻氯苯甲醛 | 甲醇 | 93.1 | 87.3 |
| 4 | 间硝基苯甲醛 | 甲醇 | 54.2 | 34.1 |
| 5 | 邻硝基苯甲醛 | 甲醇 | 89.9 | 79.5 |
| 6 | 对硝基苯甲醛 | 甲醇 | 65.7 | 41.9 |