摘要:21.BCF
网址:http://m.1010jiajiao.com/timu3_id_359046[举报]
(14分)下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素
| a | | | | | ||||||||||||||
| | | | g | | j | | | |||||||||||
| b | c | f | | i | | l | m | |||||||||||
| | | | | | | | e | | | | | | h | | k | | | |
| | d | | | | | | | | | | | | | | | | | |
(2)下列_____组元素的单质可能都是电的良导体。
A.d、e、f B.b、c、i C.c、d、g D.a、g、k
(3)表中某元素的最高价氧化物对应水化物呈两性的化学式是 ,它与短周期元素b的最高价氧化物对应水化物发生反应的离子方程式是 ;
(4)b、a与j形成原子个数比为1:1:1的化合物中含有的化学键类型是 。 查看习题详情和答案>>
(14分)下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素
(1)表中所列元素中属于主族元素的有 ;属于金属元素的有 ;e在元素周期表中的位置是 。
(2)下列_____组元素的单质可能都是电的良导体。
A.d、e、f B.b、c、i C.c、d、g D.a、g、k
(3)表中某元素的最高价氧化物对应水化物呈两性的化学式是 ,它与短周期元素b的最高价氧化物对应水化物发生反应的离子方程式是 ;
(4)b、a与j形成原子个数比为1:1:1的化合物中含有的化学键类型是 。
| a | | | | | ||||||||||||||
| | | | g | | j | | | |||||||||||
| b | c | f | | i | | l | m | |||||||||||
| | | | | | | | e | | | | | | h | | k | | | |
| | d | | | | | | | | | | | | | | | | | |
(2)下列_____组元素的单质可能都是电的良导体。
A.d、e、f B.b、c、i C.c、d、g D.a、g、k
(3)表中某元素的最高价氧化物对应水化物呈两性的化学式是 ,它与短周期元素b的最高价氧化物对应水化物发生反应的离子方程式是 ;
(4)b、a与j形成原子个数比为1:1:1的化合物中含有的化学键类型是 。
下图中每一方框中表示一种反应物或一种生成物(已知A为铵盐,常温下B、C、D是气体):

请完成下列问题:
(1)A的化学式______________________________。
(2)已知一定温度下,B和C在固定体积的容器中反应,一定时刻的浓度如下表所示:
| B | C | F |
起始浓度/(mol·L-1) | 6 | 4 | 0 |
平衡浓度/(mol·L-1) | 3 | 3 | 2 |
写出反应②的化学方程式__________________________________________________。
(3)保持温度、容器体积不变,若在起始时,只加入C和F两种物质,使平衡时F的物质的量分数与上表平衡中相同,则需加入C和F的物质的量分别为___________、____________。
(4)在测量H的相对分子质量时,一般数值都偏大,原因是_________________________。
(5)K的化学式为__________________________________________。
查看习题详情和答案>>下表是元素周期表的一部分,表中所列的字母分别代表一种元素.
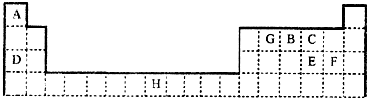
请回答下列问题:
(1)元素H位于元素周期表的 区,其原子结构示意图为 .
(2)在A、B、C、D、E、F、G送7种元素中,基态原子中未成对电子数与其所在周期数相同的元素有 种.
(3)元素D与E形成的化合物D2E的水溶液的pH≠7,原因是 (用离子方程式表示).在工业上用惰性电极电解DF的饱和溶液时,阴极的电极反应式为 .
(4)王水(浓消酸和浓盐酸以体积比1:3混合而成)可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3、还有反应生成的化合物BCF等,若BCF分子的所有原子都达到8电子结构,则BCF的电子式为 (用对应的元素符号表示).
(5)已知化合物H(GC)5,常温下呈液态,熔点为-20.5℃、沸点为103℃,易溶于非极性溶剂.据此可判断该化合物晶体为 .
查看习题详情和答案>>

请回答下列问题:
(1)元素H位于元素周期表的
(2)在A、B、C、D、E、F、G送7种元素中,基态原子中未成对电子数与其所在周期数相同的元素有
(3)元素D与E形成的化合物D2E的水溶液的pH≠7,原因是
(4)王水(浓消酸和浓盐酸以体积比1:3混合而成)可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3、还有反应生成的化合物BCF等,若BCF分子的所有原子都达到8电子结构,则BCF的电子式为
(5)已知化合物H(GC)5,常温下呈液态,熔点为-20.5℃、沸点为103℃,易溶于非极性溶剂.据此可判断该化合物晶体为