摘要:3.(1)CaCO3+CO2+H2O→Ca(HCO3)2.(2)大量燃烧煤.石油等矿物燃料.CH4.B.(5)C.
网址:http://m.1010jiajiao.com/timu3_id_358932[举报]
(2013?枣庄二模)实验室以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)为原料制取CaCl2?2H2O和CaO2的主要流程如下: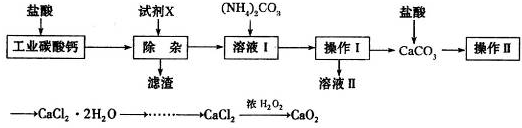
(1)加入试剂X,调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,滤渣的主要成分是
A.CaO B.CaCO3 C.NH3?H2O D.Ba(OH)2
(2)操作II中进行蒸发浓缩时,除三角架、酒精灯外,还需要的仪器有
(3)由CaCl2制取CaO2的反应中,温度不宜太高的原因是
(4)用下列装置测定工业碳酸钙的质量分数
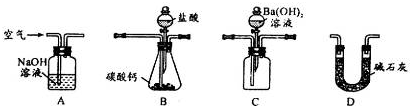
①检验装置B气密性良好的实验过程是
②按A-B-C-D顺序连接,然后从A装置通入空气,目的是
③装置D的作用为
④实验时,准确称取10.00g工业碳酸钙3份,进行3次测定,测得BaCO3沉淀的平均质量为17.73g,则样品中CaCO3的质量分数为
查看习题详情和答案>>

(1)加入试剂X,调节溶液pH为碱性环境,以除去溶液中Al3+和Fe3+,滤渣的主要成分是
Fe(OH)3、Al(OH)3
Fe(OH)3、Al(OH)3
.试剂X可以选择下列的AB
AB
(填编号).A.CaO B.CaCO3 C.NH3?H2O D.Ba(OH)2
(2)操作II中进行蒸发浓缩时,除三角架、酒精灯外,还需要的仪器有
玻璃棒和蒸发皿
玻璃棒和蒸发皿
.(3)由CaCl2制取CaO2的反应中,温度不宜太高的原因是
温度过高会导致双氧水分解
温度过高会导致双氧水分解
.(4)用下列装置测定工业碳酸钙的质量分数

①检验装置B气密性良好的实验过程是
关闭导管出口以及分液漏斗的瓶塞,打开分液漏斗的旋塞,液体不往下滴,证明气密性良好
关闭导管出口以及分液漏斗的瓶塞,打开分液漏斗的旋塞,液体不往下滴,证明气密性良好
.②按A-B-C-D顺序连接,然后从A装置通入空气,目的是
让生成的二氧化碳全部放出,进入C装置,确保实验结果的准确性
让生成的二氧化碳全部放出,进入C装置,确保实验结果的准确性
.③装置D的作用为
防止空气中的二氧化碳进入装置C中,引起实验误差
防止空气中的二氧化碳进入装置C中,引起实验误差
.④实验时,准确称取10.00g工业碳酸钙3份,进行3次测定,测得BaCO3沉淀的平均质量为17.73g,则样品中CaCO3的质量分数为
90.00%
90.00%
.下列反应中,熵显著增加的反应是( )
| A、C0(g)+2H2(g)=CH30H(1) | B、CaCO3(s)+2HCl(aq)=CaCl2(aq)+C02(g)+H20(1) | C、(NH4)2C03(s)=C02(g)+2NH3(g)+H20(1) | D、CaO(s)+C02(g)=CaC03(s) |
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4?7H2O),过程如下:

(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为:
(3)过程③中,需加入的物质是
(4)过程④中,蒸发结晶需要使用酒精灯、三角架,还需要的仪器有
(5)过程⑤调节pH可选用下列试剂中的
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70-80℃,目的是
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验.
①用分析天平称取2.700g样品;
②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;
③过滤、洗涤、干燥,称量,得固体质量为3.495g.若该聚铁主要成分为[(Fe(OH)(SO4)]n;
则该聚铁样品中铁元素的质量分数为
查看习题详情和答案>>

(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是
ACD
ACD
;A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为:
4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S
4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S
;(3)过程③中,需加入的物质是
Fe
Fe
;(4)过程④中,蒸发结晶需要使用酒精灯、三角架,还需要的仪器有
蒸发皿、玻璃棒
蒸发皿、玻璃棒
;(5)过程⑤调节pH可选用下列试剂中的
C
C
(填选项序号);A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70-80℃,目的是
促进Fe3+的水解
促进Fe3+的水解
;(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验.
①用分析天平称取2.700g样品;
②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;
③过滤、洗涤、干燥,称量,得固体质量为3.495g.若该聚铁主要成分为[(Fe(OH)(SO4)]n;
则该聚铁样品中铁元素的质量分数为
31.1%
31.1%
.(假设杂质中不含铁元素和硫元素)(2013?绍兴一模)绿色化制氢技术是现代能源工业的方向,以CaO为吸收体,将生物质(以C计)与水蒸气反应制取H2.反应装置由气化炉和燃烧炉两个反应器组成,相关反应如下表所示:
请回答下列问题:
(1)气化炉中总反应:C(s)+2H2O(g)+CaO(s)=CaCO3(s)+2H2(g)△H=
(2)燃烧炉中反应⑤所需的能量由反应④提供.如果再生1mol CaO,至少需通入纯氧
(3)当只改变温度或压力时,反应⑤有如图所示的变化:
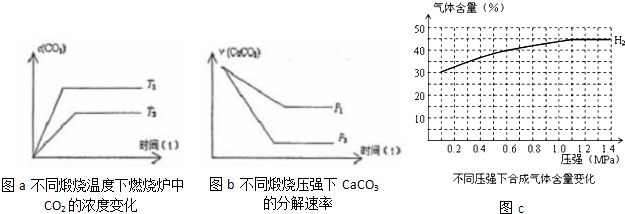
图a推知T1
图b推知P1
(4)在一定温度、不同压力时,气化炉中H2的变化量约等于CO的变化量(即△n(H2)=△n(CO)),当起始c(H2):c(CO)=3:2时,请根据n(H2)变化,补充完整图C中n(CO)图示变化.
(5)一定条件下,气化炉中的各反应达到平衡状态,采取以下措施可以提高H2产量的是
A.反应②中使用合适的催化剂 B.不断移走CaCO3,并升高气化炉内的温度
C.适当增加水蒸气的通入量 D.增加CaO的量,提高CO2的吸收率
(6)写出一条这种制H2技术的优点
查看习题详情和答案>>
| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: ①C(s)+H2O(g)=CO(g)+H2(g) △H=+131.6kJ?mol-1 ②CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2kJ?mol-1 ③CaO(s)+CO2(g)=CaCO3(s) △H=-178.3kJ?mol-1 |
通入纯氧,主要化学反应: ④C(s)+O2(g)=CO2(g) △H=-393.8kJ?mol-1 ⑤CaCO3(s)=CaO(s)+CO2(g) K |
(1)气化炉中总反应:C(s)+2H2O(g)+CaO(s)=CaCO3(s)+2H2(g)△H=
-87.9
-87.9
kJ?mol-1(2)燃烧炉中反应⑤所需的能量由反应④提供.如果再生1mol CaO,至少需通入纯氧
0.45
0.45
mol.(3)当只改变温度或压力时,反应⑤有如图所示的变化:

图a推知T1
>
>
T2(填“>”、“<”、“=”),若温度升高,平衡常数K值增大
增大
(填“增大”、“减小”、“不变”)图b推知P1
<
<
P2(填“>”、“<”、“=”),压强增大,CaCO3的分解率减小
减小
(填“增大”、“减小”、“不变”)(4)在一定温度、不同压力时,气化炉中H2的变化量约等于CO的变化量(即△n(H2)=△n(CO)),当起始c(H2):c(CO)=3:2时,请根据n(H2)变化,补充完整图C中n(CO)图示变化.
(5)一定条件下,气化炉中的各反应达到平衡状态,采取以下措施可以提高H2产量的是
BC
BC
(用相关编号填写)A.反应②中使用合适的催化剂 B.不断移走CaCO3,并升高气化炉内的温度
C.适当增加水蒸气的通入量 D.增加CaO的量,提高CO2的吸收率
(6)写出一条这种制H2技术的优点
实现了吸收剂CaO的循环,降低了能耗;实现了能量自给,符合节能减排等
实现了吸收剂CaO的循环,降低了能耗;实现了能量自给,符合节能减排等
.