网址:http://m.1010jiajiao.com/timu3_id_358291[举报]
(本小题共15分)乙基香兰素是当今世界上最重要的合成香料之一,其结构简式如下图所示。
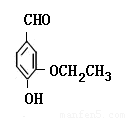
(1)(2分)以下推测正确的是 (填字母)。
A.从分子结构上看,它应该属于芳香烃
B.该物质的一个分子内含有一个碳氧双键、三个碳碳双键
C.1 mol该物质最多能与4molH2发生加成反应
D.该物质能与碳酸钠溶液反应产生CO2气体
(2)(4分)R物质属于乙基香兰素的同分异构体,其分子中苯环上有2个取代基,R可以发生水解反应生成M和N两种有机物。M可与饱和溴水反应生成白色沉淀。N的质谱图相对分子质量为32,且红外光谱图上发现有O-H键、C-H键和C-O键的振动吸收。
试写出符合条件的R的结构简式(任写两种) ; 。
(3)X也是乙基香兰素的同分异构体,可以利用X通过不同的反应制得下列物质。
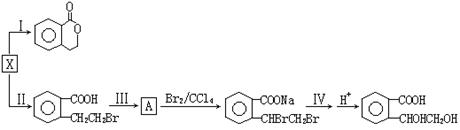
请回答下列问题:
①X中所含官能团的名称是 (2分) 反应Ⅰ的反应类型是 (2分) ;
②反应Ⅲ所需的试剂是 (2分);
③反应Ⅳ的化学方程式为 (3分)
查看习题详情和答案>>
(本小题共15分)乙基香兰素是当今世界上最重要的合成香料之一,其结构简式如下图所示。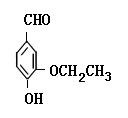
(1)(2分)以下推测正确的是 ( 填字母)。
填字母)。
| A.从分子结构上看,它应该属于芳香烃 |
| B.该物质的一个分子内含有一个碳氧双键、三个碳碳双键 |
| C.1 mol该物质最多能与4molH2发生加成反应 |
| D.该物质能与碳酸钠溶液反应产生CO2气体 |
试写出符合条件的R的结构简式(任写两种) ; 。
(3)X也是乙基香兰素的同分异构体,可以利用X通过不同的反应制得下列物质。
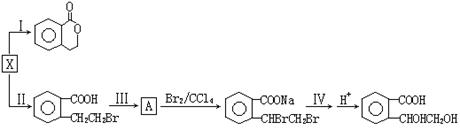
请回答下列问题:
①X中所含官能团的名称是 (2分) 反应Ⅰ的反应类型是 (2分) ;
②反应Ⅲ所需的试剂是
 (2分);
(2分);③反应Ⅳ的化学方程式为 (3分) 查看习题详情和答案>>
(本小题共12分 )某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).
)某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).

请按要求填空:
(1)利用B装置可制取的气体有______________________(写出两种即可).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
若在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实
验,实验操作、现象、结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
(本小题共15分)乙基香兰素是当今世界上最重要的合成香料之一,其结构简式如下图所示。
(1)(2分)以下推测正确的是 (填字母)。
A.从分子结构上看,它应该属于芳香烃
B.该物质的一个分子内含有一个碳氧双键、三个碳碳双键
C.1 mol该物质最多能与4molH2发生加成反应
D.该物质能与碳酸钠溶液反应产生CO2气体
(2)(4分)R物质属于乙基香兰素的同分异构体,其分子中苯环上有2个取代基,R可以发生水解反应生成M和N两种有机物。M可与饱和溴水反应生成白色沉淀。N的质谱图相对分子质量为32,且红外光谱图上发现有O-H键、C-H键和C-O键的振动吸收。
试写出符合条件的R的结构简式(任写两种) ; 。
(3)X也是乙基香兰素的同分异构体,可以利用X通过不同的反应制得下列物质。
请回答下列问题:
①X中所含官能团的名称是 (2分) 反应Ⅰ的反应类型是 (2分) ;
②反应Ⅲ所需的试剂是 (2分);
③反应Ⅳ的化学方程式为 (3分)
查看习题详情和答案>>
(本小题满分16分)
Ⅰ.汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式
(2)“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是
(3)控制城市空气污染源的方法可以有 (多选扣分)
a. 开发氢能源 b. 使用电动车 c. 植树造林 d.戴上呼吸面具
Ⅱ.A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图, B的最外层电子数比K层电子多1,
B的最外层电子数比K层电子多1,
D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空:
(1) 指出元素A在周期表中的位置 ,其气态氢化物的化学式为 。
(2) D和E两种元素相比较,非金属性较强的是(填元素符号) ,
可以验证该结论的是(填写字母序号) ;
A.比较这两种元素的常见单质的熔沸点 B.比较这两种元素的气态氢化物的熔沸点
C.比较这两种元素的气态氢化物的稳定性 D.比较这两种元素置换能力的强弱
(3)C、D、E三种元素最高价氧化物的水化物的酸性由强到弱的顺序: 。(填写化学式)
查看习题详情和答案>>