网址:http://m.1010jiajiao.com/timu3_id_357182[举报]
利用催化氧化反应将![]() 转化为
转化为![]() 是工业上生产硫酸的关键步骤。
是工业上生产硫酸的关键步骤。
已知:![]()
![]()
![]() 。
。
(1)在![]() 温度时,该反应的平衡常数
温度时,该反应的平衡常数![]() ,若在此温度下,向
,若在此温度下,向![]() 的恒容密闭容器中,充入
的恒容密闭容器中,充入![]() 和
和![]() ,则反应开始时正反应速率 逆反应速率(填“<”、“>”或“=”)。
,则反应开始时正反应速率 逆反应速率(填“<”、“>”或“=”)。
(2)在![]() 温度时,开始在
温度时,开始在![]() 的密闭容器中加入
的密闭容器中加入![]() 和
和![]() ,一定条件下当反应达到平衡时共放出热量
,一定条件下当反应达到平衡时共放出热量![]() 。此时二氧化硫的转化率为 。
。此时二氧化硫的转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使![]() 平衡浓度比原来减小的是
平衡浓度比原来减小的是
(填字母)。
 A.保持温度和容器体积不变,充入
A.保持温度和容器体积不变,充入![]()
B.保持温度和容器内压强不变,充入![]() 和
和![]()
C.降低温度
D.在其他条件不变时,减小容器的容积
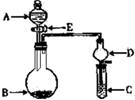
(4)有人设想以右图所示装置用电化学原理生产硫酸,写出通入
![]() 的电极的电极反应式: 。
的电极的电极反应式: 。
(5)由硫酸可制得硫酸盐。在一定温度下,向![]() 溶液中滴加
溶液中滴加![]() 溶液和
溶液和![]() 溶液,当两种沉淀共存时,
溶液,当两种沉淀共存时,![]() 。[已知该温度时,
。[已知该温度时,![]()
![]() ]
]
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤。
(1)某温度下,SO2(g)+![]() O2(g)
O2(g)![]() SO3(g)△H=-98 kJ·mol-1。开始时在
SO3(g)△H=-98 kJ·mol-1。开始时在
100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:
2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 (填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 mol O2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
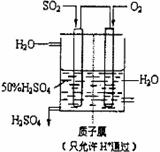
 (3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2 的电极的电极反应式: 。检验其中产物有SO42-的具体操作为 。
(3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2 的电极的电极反应式: 。检验其中产物有SO42-的具体操作为 。
(4)常温时,BaSO4的Ksp==1.08x10-10.现将等体积的BaCl2溶液与2.0x10-3mol/l的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为______________。
(5)下列关于2SO2(g)+O2(g)![]() 2SO3(g)反应的图像中,正确的是 。
2SO3(g)反应的图像中,正确的是 。

(6)SO2有氧化性又有还原性,还有漂白性。将SO2气体通入酸性KMnO4中,酸性KMnO4褪色,其中SO2体现出的性质是 。
查看习题详情和答案>>(8分)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
![]() (1)某温度下,SO3(g)
(1)某温度下,SO3(g)![]() SO2(g)+1/2O2(g);△H= +98 kJ?mol-1。开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=
SO2(g)+1/2O2(g);△H= +98 kJ?mol-1。开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=
![]() (2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 。
2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 。
![]() A.保持温度和容器体积不变,充入2mol SO3
A.保持温度和容器体积不变,充入2mol SO3
![]() B.保持温度和容器体积不变,充入2mol N2
B.保持温度和容器体积不变,充入2mol N2
![]() C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
![]() D.保持温度和容器内压强不变,充入1mol SO3
D.保持温度和容器内压强不变,充入1mol SO3
![]() E.升高温度
E.升高温度
![]() F.移动活塞压缩气体
F.移动活塞压缩气体
![]() (3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
(3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
![]() 。
。

![]()
![]()
(4)若通入SO2的速率为2.24L/min(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为 mL/min
查看习题详情和答案>>
 工业上生产硫酸时,将SO2氧化为SO3是关键一步.
工业上生产硫酸时,将SO2氧化为SO3是关键一步.(1)某温度下,2 SO2(g)+O2(g)?2SO3(g);△H=-196kJ?mol-1.开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应:2SO2(g)+O2(g)?2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是
A.保持温度和容器体积不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
D.保持温度和容器内压强不变,充入1mol SO3
E.升高温度
F.移动活塞压缩气体
(3)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
(4)在0.1mol?L-1的(NH4)2SO4溶液中,离子浓度由大到小的顺序是
(1)某温度下,2 SO2(g)+O2(g)?2SO3(g);△H=-196kJ?mol-1.开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K= .
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应:2SO2(g)+O2(g)?2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 .
A.保持温度和容器体积不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
D.保持温度和容器内压强不变,充入1mol SO3
E.升高温度
F.移动活塞压缩气体
(3)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式: .
(4)在0.1mol?L-1的(NH4)2SO4溶液中,离子浓度由大到小的顺序是 .