网址:http://m.1010jiajiao.com/timu3_id_357180[举报]
已知![]() 在水中存在下列溶解平衡:
在水中存在下列溶解平衡:
![]()
在火力发电厂燃烧煤的废气中往往含有![]() 、
、![]() 、
、![]() 、
、![]() 等。为了除去有害气体
等。为了除去有害气体![]() 并变废为宝,常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
并变废为宝,常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
(1)写出上述两个反应的化学方程式。
①![]() 与
与![]() 悬浊液反应:________;
悬浊液反应:________;
②![]() 与
与![]() 悬浊液反应:________。
悬浊液反应:________。
(2)说明用熟石灰悬浊液而不用澄清石灰水洗涤废气的原因:________。
查看习题详情和答案>>(1)SO2是重要的大气污染物,大量SO2主要来源 。
(2)SO2本身不断污染大气,它在大气中经尘粒催化,与水、氧气作用,形成危害更大的酸雨,形成酸雨的有关化学反应方程式为 。
(3)某地酸雨经检验含:Na+2.3×10-5mol·L-1、Cl-3.5×10-5mol-1、NH![]() 7.0×10-6mol·L-1,则该酸雨的pH为多少?
7.0×10-6mol·L-1,则该酸雨的pH为多少?
(4)火力发电厂燃烧煤的废气中往往含有SO2,为了除去有害气体SO2,并变废为宝,常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏,请回答:
①写出上述反应的化学方程式:SO2和CaCO3、悬浊液反应 ;SO2和Ca(OH)2悬浊液 。
②试说明用熟石灰的悬浊液,而不用澄清石灰水洗涤废气的理由。
(5)某地酸雨,每隔一定时间测定其pH。发现pH逐渐变大,其原因是 。
查看习题详情和答案>>
(2)SO2本身不断污染大气,它在大气中经尘粒催化,与水、氧气作用,形成危害更大的酸雨,形成酸雨的有关化学反应方程式为 。
(3)某地酸雨经检验含:Na+2.3×10-5mol·L-1、Cl-3.5×10-5mol-1、NH![]() 7.0×10-6mol·L-1,则该酸雨的pH为多少?
7.0×10-6mol·L-1,则该酸雨的pH为多少?
(4)火力发电厂燃烧煤的废气中往往含有SO2,为了除去有害气体SO2,并变废为宝,常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏,请回答:
①写出上述反应的化学方程式:SO2和CaCO3、悬浊液反应 ;SO2和Ca(OH)2悬浊液 。
②试说明用熟石灰的悬浊液,而不用澄清石灰水洗涤废气的理由。
(5)某地酸雨,每隔一定时间测定其pH。发现pH逐渐变大,其原因是 。
查看习题详情和答案>>
Ⅰ.火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
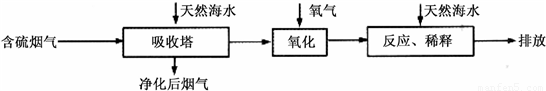
(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因______.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是______;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是______.
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KID.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=______.
(5)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%.若环境要求排放标准为c(Ag+)低于1.0×10-8mol?L-1,问该工厂处理后的废水中c(Ag+)=______,是否符合排放标准______(填“是”或“否”).
已知KSP(AgCl)=1.8×1-10mol?L2.
查看习题详情和答案>>
Ⅰ.火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
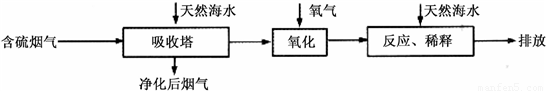
(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因______.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是______;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是______.
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KID.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=______.
(5)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%.若环境要求排放标准为c(Ag+)低于1.0×10-8mol?L-1,问该工厂处理后的废水中c(Ag+)=______,是否符合排放标准______(填“是”或“否”).
已知KSP(AgCl)=1.8×1-10mol?L2.
查看习题详情和答案>>