网址:http://m.1010jiajiao.com/timu3_id_356851[举报]
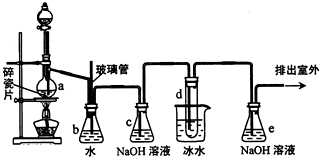 1,2一二溴乙烷可作抗爆剂的添加剂.如图为实验室制备1,2一二溴乙烷的装置图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,试管d中装有液溴.
1,2一二溴乙烷可作抗爆剂的添加剂.如图为实验室制备1,2一二溴乙烷的装置图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,试管d中装有液溴.已知:CH3CH2OH
| 浓硫酸 |
| 170℃ |
CH3CH2OH
| 浓硫酸 |
| 140℃ |
相关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
| 密度/g.cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
| 沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
| 熔点/℃ | -114.3 | 9.79 | -116.2 | -7.2 |
| 水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(2)安全瓶b在实验中有多重作用.其一可以检查实验进行中导管d是否发生堵塞,请写出发生堵塞时瓶b中的现象;如果实验中导管d堵塞,你认为可能的原因是;安全瓶b还可以起到的作用是
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析可能的原因
(5)除去产物中少量未反应的Br2后,还含有的主要杂质为
(6)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管内,则此时冷水除了能起到冷却1,2一二溴乙烷的作用外,还可以起到的作用是
(8分)请选择合适方法的字母代号填空:
(1)从煤焦油中提取二甲苯________;
(2)从海水中提取粗盐________;
(3)十六烷转变为辛烷和辛烯________;
(4)轻柴油转变为乙烯、丙烯等不饱和烃________;
(5)煤转化为焦炭、煤焦油等________;
(6)工业上由氧化铝制取金属铝________;
(7)从铁矿石中提取金属铁________;
(8)提纯氢氧化铁胶体(除去其中的杂质离子)________。
A.过滤 B.裂解 C.分馏 D.裂化 E.干馏 F.还原 G.电解 H.溶解
I.渗析 J.蒸发 K.氧化
查看习题详情和答案>>
(2)12.4g Na2X含有0.4mol Na+,Na2X的摩尔质量为
(3)相同状况下,一定体积的气态氢化物H2X的质量是等体积NH3的2倍,则X的相对原子质量为
(4)a个X原子的总质量为bg,则X的相对原子质量可表示为
| bNA |
| a |
| bNA |
| a |
(5)20g A物质和14g B物质完全反应,生成8.8g C物质、3.6g D物质和0.2mol E物质,则E物质的摩尔质量为
(6)摩尔质量为 M(g?mol-1)的某物质ag,完全溶于水得 VmL溶液,所得溶液的密度为ρ (g?mL-1),其物质的量浓度为
| 1000a |
| MV |
| 1000a |
| MV |
| 100a |
| ρV |
| 100a |
| ρV |
(7)将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应.则所用盐酸中HCl的物质的量浓度为
(1)同位素种类由______________决定。
(2)元素种类由______________决定。
(3)某元素有无同位素由______________决定。
(4)核素相对原子质量由______________决定。
(5)主族元素的化学性质主要由______________决定。
(6)核电荷数由______________决定。
(7)碱金属原子失电子能力相对强弱由______________决定。
(8)原子得失电子能力相对强弱由______________决定。
查看习题详情和答案>>(10分)
I.(4分)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:

(1)该温度下,中性溶液的pH= 。
(2)该温度下0.01 mol/L NaOH溶液的pH= 。
II. (6分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
|
温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是 (填字母)。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为 。
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。

③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为 。
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大:
。
查看习题详情和答案>>