网址:http://m.1010jiajiao.com/timu3_id_35684[举报]
根据下列五种元素的第一至第四电离能数据(单位: kJ·mol-1),回答下列各题:
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2 080 |
4 000 |
6 100 |
9 400 |
|
R |
496 |
4 562 |
6 912 |
9 543 |
|
S |
738 |
1 451 |
7 733 |
10 540 |
|
T |
578 |
1 817 |
2 745 |
11 575 |
|
U |
420 |
3 100 |
4 400 |
5 900 |
(1)在周期表中,最可能处于同一族的是________。
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是________。
A.S2+ B.R2+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是____。
A.硼 B.铍 C.氦 D.氢
(4)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明:______,如果U元素是短周期元素,你估计它的第2次电离能飞跃数据将发生在失去第_____个电子时。
(5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________,其中元素________的第一电离能异常高的原因是__________________。
查看习题详情和答案>>
X、Y、Z、R 四种短周期元素,原子序数依次增大。已知:X、R处于同一主族,Y元素的最高正价和最低负价的绝对值相等,X与Y元素形成的一种物质是天然气的主要成分;Y与Z元素形成的一种气体会使大气产生“温室效应”。
请回答下列问题:
(1)X、Y、Z三元素所形成的单质或化合物之间,可按下图装置组成燃料电池。
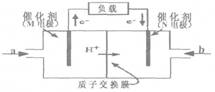
若b口通入的是气体Z2,则a口通入的物质可以是 、 、 (分别填写只由一种、两种、三种元素组成的物质,用化学式表示);M电极的名称为 (填“正极”、“负极”或“阴极”、“阳极”);N电极的电极反应式为 (用化学式表示)。
(2)日常生活中我们经常用到的一种物质其主要成分的化学式为Y18X35Z2R,这种物质的学名为 ,制造这种物质的反应叫 ,写出该反应的化学方程式 。
(3)合成氨工业中,原料气制备的其中一个反应为:YZ+X2Z(g)![]() YZ2+X2;
YZ2+X2;
已知该反应化学平衡常数K和温度T的关系如下表:
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
则下列有关的叙述正确的是 。
A.该反应![]() <0
<0
B.若绝热时(容器内外没有热量交换),改变某一条件平衡向逆反应方向移动,刚容器内气体的温度一定升高
C.若反应在830℃的温度达到平衡状态,反应容器内的四种物质的浓度则一定相等
D.该反应在某温度下,YZ、X2Z的物质的量浓度与时间的关系如下图所示,据此可计算得YZ的转化率为80%

(1)常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解.写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式
(3)A、B、D、E四种元素组成的某无机化合物浓度为0.1mol/L时,pH最接近
A.5.6B.7.0 C.8.4D.13.0
(4)在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g)
 2CA3(g)
2CA3(g)△H=-92.4kJ?mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2mol,总容积为1.0L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是
A.C2 0.6mol,A2 0.5mol,CA3 0mol
B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L,CA3 0.2mol/L
②求算此平衡体系的平衡常数K=
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将
| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|
| 1.00 |
| 0.9 |
| c2(NH3) |
| c(N2)×c3(H2) |
(
| ||||
(
|
④已知0.4mol 液态C2 A4与足量的液态双氧水反应,生成C2和水蒸气,放出256.65kJ的热量.写出该反应的热化学方程式
(9分) A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+l,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物。 回答下列问题:
(1)写出下列各元素的名称:C___________ E____________
(2)已知:BA3DA(g)+A2D(g)=BD2(g)+3A2(g) △H= +49.0kJ/mol
BA3DA(g)+1/2D2(g)=BD2(g)+2A2(g) △H = 一192.9kJ/mol
试写出:气态BA3DA完全燃烧生成气态A2D的热化学方程式(用推出的元素符号写)
(3)![]() 点燃不纯的A2气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。
点燃不纯的A2气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。
![]()

(4)由A、B、C、D四种元素可以组成多种既能与强酸反应又能与强碱反应的化合物。其中有一种在加热条件下能分解生成等物质的量的三种产物,该化合物是 ;另一种是人体必须的营养物质,它的相对分子质量为75,该化合物是 。
查看习题详情和答案>>(12分)有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A的原子半径最小,B与A能以原子个数1:1、1:2或1:3等组成多种常见化合物;C的最高正价和最低负价的代数和为2;D与F位于同一主族;E与D能以原子个数1:1或2:1形成两种常见化合物.
(1)A与B能形成一种最简单的直线型分子,其电子式为 。
(2) CA3极易溶于液态A2D中,其原因是 。
(3)将标准状况下的4.48 L CA3完全溶解在含0.1mol HCl的水溶液中得1L溶液,所得溶液pH=9,其中离子浓度由大到小的顺序是 。
(4)物质B2A6D在电解质EDA的溶液作用下,可形成燃料电池,则该电池的负极反应式为 。
(5)E与F形成的化合物属于 型化合物(填:离子或共价),用惰性电极电解该化合物的水溶液时,有固体析出,则电解总反应方程式为 。
查看习题详情和答案>>